
【题目】某新型电池,以NaBH4(B的化合价为+3价)和H2O2作原料,该电池可用作深水勘探等无空气环境电源,其工作原理如图所示。下列说法正确的是
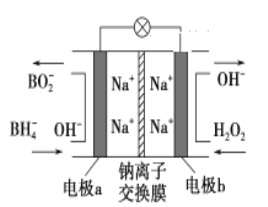
A. 电池工作时Na+从b极区移向a极区
B. a极上的电极反应式为:BH4-+8OH--8e-===BO2-+6H2O
C. 每消耗3 mol H2O2,转移3 mol e-
D. b极上的电极反应式为:H2O2+2e-+2H+===2H2O
【答案】B
【解析】
由原电池工作原理示意图可知反应中BH4-被氧化为BO2-,应为原电池的负极反应,正极H2O2得电子被还原生成OH-,结合原电池的工作原理分析解答该题。
由原电池工作原理示意图可知反应中BH4-被氧化为BO2-,应为原电池的负极反应,电极反应式为BH4-+8OH--8e-=BO2-+6H2O。正极H2O2得电子被还原生成OH-,电极反应式为H2O2+2e-=2OH-。则
A.该装置是原电池,原电池放电时,阳离子向正极移动,所以Na+从a极区移向b极区,故A错误;
B.反应中BH4-被氧化为BO2-,应为原电池的负极反应,电极反应式为BH4-+8OH--8e-=BO2-+6H2O,故B正确;
C.根据b电极反应式H2O2+2e-=2OH-可判断每消耗3molH2O2,转移的电子为6mol,故C错误;
D.b电极为正极,反应式应该为H2O2+2e-=2OH-,故D错误;
故答案选B。


科目:高中化学 来源: 题型:
【题目】如图为某植物叶绿体结构和功能的示意图。请分析回答问题:
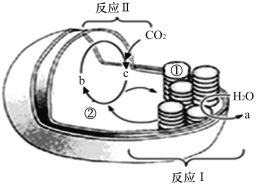
(1)物质a是____________,物质b是________________。
(2)光合作用的光反应阶段发生在_______(填“Ⅰ”或“Ⅱ”),该反应将光能转变为__________________。
(3)叶绿体增加膜面积的方式是____________________________________。在适宜光照和温度条件下培养,由①处转移至②处的物质主要是_____________________。
(4)该植物进行光合作用时,突然停止光照,C3的含量__________(填“升高”或“降低”或“不变”)。若用H![]() O培养该植物,发现叶肉细胞中出现了(CH
O培养该植物,发现叶肉细胞中出现了(CH![]() O),分析其最可能的转化途径是:_______________________(用相关物质、过程和箭头表示)。
O),分析其最可能的转化途径是:_______________________(用相关物质、过程和箭头表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硝酸工业尾气中的氮氧化合物NOx(NO、NO2、N2O4)常用的处理方法有以下两种:
①碱液(Na2CO3或NaOH溶液)吸收法。用Na2CO3溶液吸收反应原理如下:
NO + NO2 + Na2CO3 == 2NaNO2 + CO2;2NO2 + Na2CO3 == NaNO2 + NaNO3 + CO2
②氨的催化氧化法,反应原理是:NOx + NH3![]() N2 + H2O
N2 + H2O
现将标准状况下2.016 L氮氧化合物NOx 通入50 mL 1.0 mol·L-1的Na2CO3溶液,恰好反应完全,且测得反应后溶液中n(NO2-)∶n(NO3-) = 4∶1,下列说法正确的是
A. 混合气体中V(N2O4) = 0.336 L
B. 混合气体中n(NO)∶n(NO2) = 1∶5
C. NOx能够完全被Na2CO3溶液吸收,则x ≤ 1.5
D. 如采用氨的催化氧化法处理,理论消耗n(NH3) = ![]() mol
mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应2KMnO4+16HCl=2KCl+2MnCl2+5Cl2![]() +8H2O,下列说法正确的是 ( )
+8H2O,下列说法正确的是 ( )
A.氧化产物与还原产物的物质的量之比为2:5
B.每生成1molCl2时转移2mol e-
C.KMnO4的还原性强于Cl2的还原性
D.参与反应的氧化剂与还原剂的物质的量之比为1:8
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.1000mol/L NaOH溶液滴定20.00mL 0.1000mol/L HCl溶液,滴定曲线如图所示,下列说法不正确的是
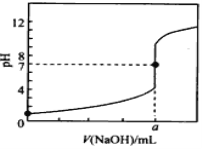
A. a=20.00
B. 滴定过程中,可能存在:c(Cl-)>c(H+)>c(Na+)>c(OH-)
C. 若将盐酸换成相同浓度的醋酸,则滴定到pH=7时,a<20.00
D. 若用酚酞作指示剂,当滴定到溶液明显由无色变为浅红色时立即停止滴定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一块金属钠投入到滴有紫色石蕊试液的盛冷水的烧杯中,甲同学认为可观察到下列现象,其中正确的有( )
①钠投入水中,先沉入水底,后浮出水面
②钠立即与水反应,并有气体产生
③反应后溶液变红
④钠熔成闪亮的小球
⑤小球在水面上四处游动
⑥有“嘶嘶”的响声发出
A. ①②③④ B. ②③④⑤
C. ②④⑤⑥ D. ③④⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组测定某Fe2(SO4)3样品(只含少量FeCl2杂质)中铁元素的质量分数,按以下实验步骤进行操作:
①称取ag样品,置于烧杯中;
②加入50 mL 1.0 mol/L稀硫酸和一定量的蒸馏水,使样品溶解,然后准确配制成250.0 mL溶液;
③量取25.0 mL步骤②中配得的溶液,置于烧杯中,加入适量的氯水,使反应完全;
④加入过量氨水,充分搅拌,使沉淀完全;
⑤过滤,洗涤沉淀;
⑥将沉淀转移到某容器内,加热、搅拌,直到固体由红褐色全部变为红棕色后,在干燥器中冷却至室温后,称量;
⑦……

请根据上面叙述,回答:
(1)上图所示仪器中,本实验步骤①②③中必须用到的仪器有E和________(填字母)。
(2)步骤②中:配制50 mL,1.0 mol/L稀H2SO4需要98%(密度1.84 g/cm3)的浓H2SO4体积为________ mL,量取该体积的浓H2SO4用到量筒规格是________。
(3)样品中的杂质Fe2+有较强的还原性,完成并配平下列反应的离子方程式![]() Fe2++
Fe2++![]() ClO2+
ClO2+![]()
![]() ===
===![]() Fe3++
Fe3++![]() Cl-+
Cl-+![]() H2O__________________,从理论上分析,上述实验中若将氯水改为ClO2时,对实验结果的影响是__________(填“偏大”“偏小”或“不影响”),等物质的量ClO2与Cl2的氧化效率之比为__________。
H2O__________________,从理论上分析,上述实验中若将氯水改为ClO2时,对实验结果的影响是__________(填“偏大”“偏小”或“不影响”),等物质的量ClO2与Cl2的氧化效率之比为__________。
(4)第⑥步的操作中,将沉淀物转移到________(填仪器名称)中加热,冷却到室温,称量其质量为m1g,再次加热并冷却至室温称量其质量为m2g,若m1与m2差值较大,接下来的操作应当是________________。
(5)若步骤⑥不在干燥器中冷却,则测定的铁元素的质量分数会________(填“偏大”“偏小”或“不影响”);若容器质量是W1g,最终容器和固体的总质量是W2g,则样品中铁元素的质量分数为________(列出算式,不需化简)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列可逆反应:A(g)+B(g) ![]() xC(g),在不同条件下生成物C在反应混合物中的质量分数(C%)和反应时间(t)的关系如下图:
xC(g),在不同条件下生成物C在反应混合物中的质量分数(C%)和反应时间(t)的关系如下图:
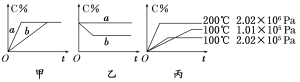
请根据图像回答下列问题:
(1)若甲图中两条曲线分别表示有催化剂和无催化剂的情况,则 曲线表示无催化剂时的情况(填字母,下同);
(2)若乙图表示反应达到平衡后分别在恒温恒压条件下和恒温恒容条件下向平衡混合气体中充入惰性(与反应体系中任一物质均不反应)气体后的情况,则 曲线表示恒温恒容的情况;
(3)根据丙图可以判断该可逆反应的正反应是 热反应(填“吸”或“放”);
(4)化学计量数x的值 (填取值范围);判断的依据是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com