
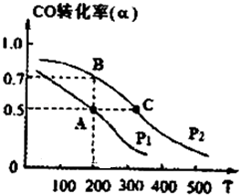
 ��ҵ��һ����CO��H2Ϊԭ�Ϻϳɼ״����÷�Ӧ���Ȼ�ѧ����ʽΪ��CO��g��+2H2 ��g��?CH3OH ��g����H=-116kJ/mol
��ҵ��һ����CO��H2Ϊԭ�Ϻϳɼ״����÷�Ӧ���Ȼ�ѧ����ʽΪ��CO��g��+2H2 ��g��?CH3OH ��g����H=-116kJ/mol���� ��1����ѧƽ�ⳣ������ʽΪ������Ũ�ȵ���֮�����Ϸ�Ӧ��Ũ����֮����
��2����������ļ�ǿ���Ƿ�Ӧ��Ũ�ȵ����ӣ�ƽ�������ƶ�����������÷�Ӧ�ķ�Ӧ���������ת���ʣ�
��3���൱����ѹǿ��ƽ�������ƶ���
��4�����¶�Խ�߷�Ӧ����Խ������ʱ��Խ�̣�
���¶Ȳ��䣬ƽ�ⳣ�����䣬����A���¶��µ�ת������ƽ��ʱ�������ʵ�Ũ�ȣ�
��� �⣺��1���÷�Ӧ�Ļ�ѧƽ�ⳣ������ʽΪK=$\frac{C��C{H}_{3}OH��}{C��CO��{C}^{2}��{H}_{2}��}$���ʴ�Ϊ��$\frac{C��C{H}_{3}OH��}{C��CO��{C}^{2}��{H}_{2}��}$��
��2��a����ʱ��CH3OH�뷴Ӧ�������룬��Ӧ���ʼ�С��ת�������ӣ���a��ѡ��
b�����ͷ�Ӧ�¶ȣ���Ӧ���ʼ�С��ת�������ӣ���b��ѡ��
c��ʹ�ø�Ч���������ʼӿ죬��ƽ�ⲻ�ƶ���ת���ʲ��䣬��c��ѡ��
d��������ϵѹǿ��ѹǿԽ������Խ�죬ƽ�������ƶ���ת�������ӣ���ѡd��
�ʴ�Ϊ��d��
��3��ƽ����������ݻ�ѹ����ԭ����$\frac{1}{2}$���൱����ѹǿ��a��c��H2�����٣����ѹ����ԭ����һ�룬���ƽ�ⲻ�ƶ���Ũ��Ӧԭ����2����ƽ�������ƶ����ƶ��Ľ���Ǽ��������ǵ���������Ũ��Ӧ��ԭƽ��Ļ��������ӣ���a��ѡ��b�������淴Ӧ���ʶ��ӿ죬��b��ѡ��c��ƽ�������ƶ���CH3OH�����ʵ������ӣ���c��ȷ��d������ƽ��$\frac{C��{H}_{2}��}{C��C{H}_{3}OH��}$�ķ��Ӻͷ�ĸ�����������ʵ���Ͼ������������ʵ����ͼ״������ʵ���֮�ȣ���Ϊƽ�������ƶ������������ʵ����ڼ�С���״����������ӣ����ߵı�ֵ��С����d��ȷ���ʴ�Ϊ��cd��
��4������ͼ��֪A�����C���¶ȣ��¶�Խ�߷�Ӧ����Խ������ʱ��Խ�̣�����tA����tC���ʴ�Ϊ�����ڣ�
��CO��g��+2H2��g��?CH3OH��g��
����Ũ�� 1mol/L 2mol/L 0
�仯�� 0.5mol/L 1mol/L 0.5mol/L
ƽ���� 0.5mol/L 1mol/L 0.5mol/L
��K=$\frac{0.5mol/L}{0.5mol/L\\;����1mol/L��^{2}}$=1L2mol-2��
�ʴ�Ϊ��1L2mol-2��
���� ���⿼����������ĸı��ƽ���ƶ���Ӱ�죬�Լ�ƽ�ⳣ����Ӱ�����صĿ��飬��Ŀ�ѶȲ���ѧ��ֻҪ�������⼴�ɣ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
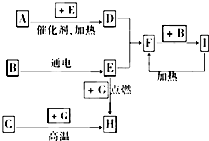 ��������ѧ��ѧ�г������ʼ�ķ�Ӧת����ϵͼ�����в��ֲ�������ȥ�������£�GΪ���嵥�ʣ�B��IΪҺ�壬���Ϊ���壮AΪ�����I��Ũ��Һ��G�ڼ�������������F��B��C�� H��������ҵ��ұ�������Ļ�ԭ�����밴Ҫ����գ�
��������ѧ��ѧ�г������ʼ�ķ�Ӧת����ϵͼ�����в��ֲ�������ȥ�������£�GΪ���嵥�ʣ�B��IΪҺ�壬���Ϊ���壮AΪ�����I��Ũ��Һ��G�ڼ�������������F��B��C�� H��������ҵ��ұ�������Ļ�ԭ�����밴Ҫ����գ��鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 250 mL����ƿ | B�� | ������ƽ | C�� | ��ͷ�ι� | D�� | �ձ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �յ���Ƕп�飬п���������Է����屻��ʴ | |
| B�� | �ڳ�ʪ�����Ի����У������ĵ绯ѧ��ʴ��Ҫ�����ⸯʴ | |
| C�� | ������������������� | |
| D�� | �ɽ��������ֹ������ֱ����Դ�����������Ա��������ܸ�ʴ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 �������仯�����й㷺��Ӧ�ã�
�������仯�����й㷺��Ӧ�ã��鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �� | B�� | �ڢۢ� | C�� | �ڢ� | D�� | �٢ڢۢ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 146C��������Ϊ14 | B�� | 146C��������Ϊ14 | ||
| C�� | 146C��126C��Ϊͬλ�� | D�� | 146C��Ħ������Ϊ14 |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com