
| A. | 若两种离子分别为X2-,Y-,则X2-的还原性一定大于Y- | |
| B. | 若两种离子分别为Xa+,Yb-,则由mXa+与nYb-得,m+a=n-b | |
| C. | X、Y一定不是同周期元素 | |
| D. | 若X的原子半径大于Y,则气态氢化物的稳定性HmX一定大于HnY |
分析 A.简单离子的电子层结构相同,X、Y位于同周期,为非金属元素,原子序数越大的非金属性强,对应离子的还原性弱;
B.简单离子的电子层结构相同,则核外电子数相同,据此解答;
C.简单离子的电子层结构相同,X、Y均为阴离子、或均为阳离子在同一周期,否则不在同一周期;
D.简单离子的电子层结构相同,X的原子半径大于Y,X可能为金属.
解答 解:A.单离子的电子层结构相同,X、Y位于同周期,为非金属元素,Y的原子序数大,则X2-的还原性一定大于Y-,故A正确;
B.由mXa+与nYb-,离子的电子层结构相同,则核外电子数相同,所以m-a=n+b,故B错误;
C.简单离子的电子层结构相同,X、Y均为阴离子、或均为阳离子在同一周期,若一个为阳离子一个为阴离子,则一定不在同一周期,故C错误;
D.简单离子的电子层结构相同,X的原子半径大于Y,X可能为金属,则不存在气态氢化物,故D错误;
故选A.
点评 本题考查具有相同电子层结构的离子,明确X、Y可能为阴离子、阳离子及相对位置是解答本题的关键,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 元素a与氢元素能形成多种原子个数之比为1:1的化合物 | |
| B. | 元素b的单质不能与无水乙醇反应 | |
| C. | 元素c与元素d形成的化合物的水溶液呈碱性 | |
| D. | 元素a与元素d形成的化合物中肯定含有极性键,不可能含有非极性键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
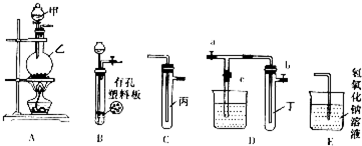
| 实验序号 | 实验操作 | 现象 | 结论 |
| Ⅰ | 将氯水滴入品红溶液 | 褪色 | 氯气与水反应的产物有漂白性 |
| Ⅱ | 氯水中加入NaHCO3粉末 | 有无色气泡产生 | 氯气与水反应的产物具有 较强的酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在中和热的测定实验中,将氢氧化钠溶液迅速倒入盛有盐酸的量热计中,立即盖上盖板,用环形玻璃搅拌棒不断搅拌,准确读出反应体系的最高温度 | |
| B. | 实验事实证明乙酸乙酯中少量乙醇可以用水洗方法除去,其原理与溴水中加四氯化碳萃取溴类似 | |
| C. | 油脂制肥皂实验中加乙醇的目的是增大油脂的溶解度,加快油脂皂化反应速率 | |
| D. | 当高锰酸钾晶体结块时,应在研钵中用力研磨,以得到细小晶体,有利于加快反应或溶解的速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
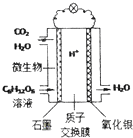 最近科学家研制的一种新型“微生物电池”可以将污水中的有机物转化为H2O和CO2,同时产生电能,其原理示意如图.下列有关该电池的说法正确的是( )
最近科学家研制的一种新型“微生物电池”可以将污水中的有机物转化为H2O和CO2,同时产生电能,其原理示意如图.下列有关该电池的说法正确的是( )| A. | 氧化银电极上反应为:Ag2O+2e-═2Ag+O2- | |
| B. | 石墨电极上反应为:C6H12O6+6H2O+24e-═6CO2↑+24H+ | |
| C. | 每转移4mol电子,氧化银电极产生22.4LCO2气体(标准状况) | |
| D. | 每30g C6H12O6参与反应,有4mo1 H+经质子交换膜进入正极区 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在0.1mol/LNaHCO3 溶液中有:c(Na+)>c(HCO3-)+c(CO32-)+c(OH-) | |
| B. | 在NaHSO4溶液中有:c(Na+)=c(SO42-)=c(H+) | |
| C. | 在新制氯水中加入KOH至溶液呈中性,则溶液中有:c(K+)=2c(ClO-)+C(HClO) | |
| D. | 将等物质的量浓度的Na2SO3溶液和NaHSO4溶液等体积混合后的混合溶液中:c(OH-)-c(H2SO3)=c(H+)+c(SO32-) |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
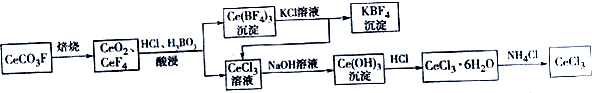
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲苯的结构式:C7H8 | B. | 乙烷的结构简式:CH3CH3 | ||
| C. | 甲醇的电子式:CH3OH | D. | 乙醇的分子式:CH3CH2OH |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com