
 用惰性电极电解物质的量比为2:1的NaCl与NaHCO3混合溶液,溶液pH变化如图1所示.
用惰性电极电解物质的量比为2:1的NaCl与NaHCO3混合溶液,溶液pH变化如图1所示.分析 (1)在0→t1时间内,阳极上Cl-放电生成Cl2,阴极上H2O放电生成H2,同时阴极附近有OH-生成,阴极附近发生的反应为OH-+HCO3-=CO32-+H2O,导致溶液pH升高;
(2)a点溶液中溶质为NaCl与NaHCO3,NaHCO3中HCO3-水解能力大于电离能力而导致溶液呈碱性;0→t1时间内,生成的OH-和HCO3-反应生成CO32-,碳酸钠水解能力大于碳酸氢钠导致溶液碱性增强但水解程度仍然不大;
(3)0→t1时间内,溶液中的溶质先是NaCl与NaHCO3,随着电解的进行,溶液中n(NaCl)、n(NaHCO3)减少、n(Na2CO3)增加,t1时刻时,生成的NaOH恰好将NaHCO3完全转化为Na2CO3;
(4)电解氯化钠溶液制取NaClO溶液,阳极上生成Cl2,阴极上生成H2,同时阴极附近有NaOH生成,生成的Cl2和NaOH反应生成NaClO,为了Cl2和NaOH充分接触,生成的Cl2应该通过溶液和NaOH反应,所以b电极上生成Cl2,a电极上生成H2,阳极上应该用石墨作电极,阴极上用Fe作电极.
解答 解:(1)在0→t1时间内,阳极上Cl-放电生成Cl2,阴极上H2O放电生成H2,同时阴极附近有OH-生成,阴极附近发生的反应为OH-+HCO3-=CO32-+H2O,导致溶液pH升高,阳极、阴极反应式分别为:2Cl--2e-=Cl2↑、2H2O+2e-=H2↑+2OH-,
故答案为:2Cl--2e-=Cl2↑;2H2O+2e-=H2↑+2OH-;(2)a点溶液中溶质为NaCl与NaHCO3,NaHCO3中HCO3-水解能力大于电离能力而导致溶液呈碱性,所以溶液的pH>7;0→t1时间内,生成的OH-和HCO3-反应生成CO32-,碳酸钠水解能力大于碳酸氢钠导致溶液碱性增强但水解程度仍然不大,所以0→t1时间内,溶液pH升高比较缓慢,
故答案为:NaHCO3中HCO3-水解能力大于电离能力而导致溶液呈碱性;碳酸钠水解能力大于碳酸氢钠导致溶液碱性增强但水解程度仍然不大;
(3)0→t1时间内,溶液中的溶质先是NaCl与NaHCO3,随着电解的进行,溶液中n(NaCl)、n(NaHCO3)减少、n(Na2CO3)增加,t1时刻时,生成的NaOH恰好将NaHCO3完全转化为Na2CO3,溶液中的溶质为NaCl、Na2CO3,
故答案为:说明该时刻生成的NaOH恰好将NaHCO3完全转化为Na2CO3,溶液中的溶质为NaCl、Na2CO3;
(4)电解氯化钠溶液制取NaClO溶液,阳极上生成Cl2,阴极上生成H2,同时阴极附近有NaOH生成,生成的Cl2和NaOH反应生成NaClO,为了Cl2和NaOH充分接触,生成的Cl2应该通过溶液和NaOH反应,所以b电极上生成Cl2,a电极上生成H2,阳极上应该用石墨作电极,阴极上用Fe作电极,则a是阴极、b是阳极,
a连接电源负极、b连接电源正极,a电极反应式为2H2O+2e-=H2↑+2OH-,b电极材料是石墨,电极反应式为2Cl--2e-=Cl2↑,
故答案为:负;2H2O+2e-=H2↑+2OH-;石墨;2Cl--2e-=Cl2↑.
点评 本题考查了电解原理,为高频考点,明确各个电极上发生的反应是解本题关键,难点是判断(4)题中阴阳极,要结合生产实际分析解答,易错点是电极反应式的书写,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 硫原子的原子结构示意图: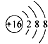 | |
| B. | NH4Cl的电子式: | |
| C. | ${\;}_{62}^{144}$Sm与${\;}_{62}^{150}$Sm为不同的核素,有不同的化学性质 | |
| D. | 在固态水中,水分子间以氢键结合成排列规整的晶体,在这种晶体中有空隙,造成体积膨胀,密度减小至低于水的密度 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ③④ | C. | ②④ | D. | ①③ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

 得到碘酸钾晶体,你建议的方法是蒸发结晶.
得到碘酸钾晶体,你建议的方法是蒸发结晶.| 温度/℃ | 0 | 10 | 20 | 40 | 60 | 80 |
| KIO3 g/100g水 | 4.60 | 6.27 | 8.08 | 12.6 | 18.3 | 24.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Li2C2水解生成C2H4 | B. | Al4C3水解生成丙炔 | ||
| C. | Mg2C3水解生成丙烯 | D. | ZnC2水解生成C2H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C3H8、C2H5Br | B. | C4H10、C3H2Cl6 | C. | C5H12、C2H6O | D. | C6H14、C2H4O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 它们相差一个电子层 | B. | 它们都有强还原性 | ||
| C. | 钠原子、钠离子均为同一元素 | D. | 灼烧时,它们的焰色反应都呈黄色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com