
一定量的甲烷燃烧后产物为CO、CO2和H2O(g),共重28.8 g,此混合气体缓慢通过浓H2SO4后,浓H2SO4增重14.4 g。则燃烧产物中CO2的质量为( )
A.4.4 g
B.8.8 g
C.13.2 g
D.6.6 g
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:山东省高青一中2009-2010学年度高二上学期期末模块检测考试化学试题 题型:022
全球气候变暖已经成为全世界人类面临的重大问题,温家宝总理在“哥本哈根会议”上承诺到2020年中国减排温室气体40%.
(1)地球上的能源主要源于太阳,绿色植物的光合作用可以大量吸收CO2以减缓主要过程可以描述分为下列三步(用“C5”表示C5H10O4,用“C3”表示C3H6O3):
Ⅰ、H2O(1)=2H+(aq)+1/2O2(g)+2e- ΔH=+284 kJ/mol
Ⅱ、CO2(g)+C5(s)+2H+(aq)=2C![]() (s) ΔH=+396 kJ/mol
(s) ΔH=+396 kJ/mol
Ⅲ、12C3+(s)+12e-=C6H12O6(葡萄糖、s)+6C5(s)+3O2(g) ΔH=-1200 kJ/mol
温室效应,写出绿色植物利用水和二氧化碳合成葡萄糖并放出氧气的热化学方程式________.
(2)降低大气中CO2的含量及有效地开发利用CO2,目前工业上有一种方法是用产燃料甲醇.为探究反应原理,现进行如下实验,在体积为1 L的恒容密闭容器中,充入lmol CO2和3 mol H2,一定条件下发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)CO2来生ΔH=-49.0 kJ/mol.测得CO2和CH3OH(g)的浓度随时间变化如图所示.
CH3OH(g)+H2O(g)CO2来生ΔH=-49.0 kJ/mol.测得CO2和CH3OH(g)的浓度随时间变化如图所示.

①从反应开始到平衡,氢气的平均反应速率
v(H2)=________mol/(L·min);②氢气的转化率=________;
③该反应的平衡常数为________(保留小数点后2位);
④下列措施中能使平衡体系中n(CH3OH)/n(CO2)增大的是________.
A.升高温度
B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离出去
D.再充入1 mol CO2和3 mol H2
⑤当反应达到平衡时,H2的物质的量浓度为c1,然后向容器中再加入一定量H2,待反应再一次达到平衡后,H2的物质的量浓度为c2.则c1________c2的关系(填>、<、=).
(3)减少温室气体排放的关键是节能减排,大力开发利用燃料电池就可以实现这一目标.如图所示甲烷燃料电池就是将电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定.将其插入KOH溶液从而达到吸收CO2的目的.请回答:
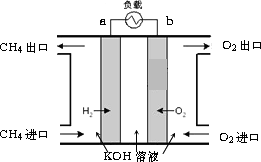
①通入甲烷一极的电极反应式为________;
②随着电池不断放电,电解质溶液的pH________(填“增大”、“减小”或“不变”).
③通常情况下,甲烷燃料电池的能量利用率________(填“大于”、“小于”或“等于”)甲烷燃烧的能量利用率.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com