
| 选项 | 实验操作 | 实验目的或结论 |
| A | 在少量无水乙醇中加入金属Na,缓慢生成可以在空气中燃烧的气体 | CH3CH2OH是弱电解质 |
| B | 将SO2气体通入紫色石蕊溶液中,观察溶液颜色的变化 | 能证明SO2具有漂白性 |
| C | 向2mL1mol•L-1NaOH溶液中先加入0.2mL1mol•L-1FeCl3溶液,再加入0.2mL1mol•L-1MgCl2溶液 | 证明Ksp[Mg(OH)2]>Ksp[Fe(OH)3] |
| D | 向2mL品红溶液和2mL加入少许醋酸的品红溶液中分别滴入3滴“84”消毒液,观察红色褪色的快慢 | 证明溶液pH的减少,“84”消毒液的氧化能力增强 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.乙醇不发生电离,不属于电解质;
B.二氧化硫不能使指示剂褪色,应该用品红溶液检验二氧化硫的漂白性;
C.氢氧化钠过量,镁离子直接与氢氧根离子生成氢氧化镁沉淀,无法据此判断氢氧化镁和氢氧化铁的溶度积;
D.NaClO具有漂白性,酸性条件下漂白性更强,则滴有醋酸的品红溶液的红色褪色的快.
解答 解:A.钠与乙醇中的羟基H反应生成氢气,但CH3CH2OH不发生分离,为非电解质,故A错误;
B.将SO2气体通入紫色石蕊溶液中,反应生成的亚硫酸使石蕊试液变红,但不会褪色,无法据此检验二氧化硫的漂白性,故B错误;
C.向2mL1mol•L-1NaOH溶液中先加入0.2mL1mol•L-1FeCl3溶液,由于氢氧化钠过量,过量的NaOH与加入的氯化镁溶液反应生成氢氧化镁沉淀,无法证明Ksp[Mg(OH)2]、Ksp[Fe(OH)3]的大小,故C错误;
D.向2mL品红溶液和2mL加入少许醋酸的品红溶液中分别滴入3滴NaClO的84消毒液,观察到滴有醋酸的品红溶液的红色褪色的快,说明溶液pH的减少,酸性增强,84消毒液的氧化能力增强,故D正确;
故选D.
点评 本题考查化学实验方案的评价,为高频考点,涉及电解质与非电解质、二氧化硫、次氯酸的漂白性、难溶物溶度积大小比较等知识,明确常见元素及其化合物性质为解答关键,试题有利于提高学生的分析能力及灵活应用能力.


科目:高中化学 来源: 题型:选择题
| A. | 3:1:1:2 | B. | 2:2:2:1 | C. | 3:1:4:2 | D. | 2:1:1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碘和干冰的升华 | B. | 二氧化硅和生石灰的熔化 | ||
| C. | 氯化钠和铁的熔化 | D. | 金刚石的熔化和冰的融化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙酸乙酯与乙醇的分离可用分液操作 | |
| B. | 滴定管、容量瓶、分液漏斗等仪器,在使用前均须冼净并检查是否漏水 | |
| C. | 碘酒中加CCl4振荡睁置后,上层几乎为无色,下层为紫色 | |
| D. | 蒸馏、分馏和干馏都是利用物质沸点不同而将物质分离的方法 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
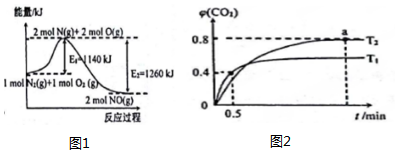
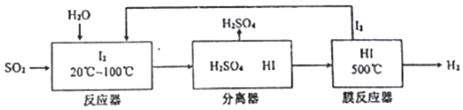
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
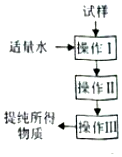 实验室按照如图操作程序提纯某种物质,下列分析一定正确的是( )
实验室按照如图操作程序提纯某种物质,下列分析一定正确的是( )| A. | 操作I一定是过滤,其目的是将固液分离 | |
| B. | 可以提纯含少量氧化铁杂质的氧化铝 | |
| C. | 可以提纯含少量氯化钠杂质的硝酸钾 | |
| D. | 可以提纯含少量碘杂质的氧化钠 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| t/min | 0 | 1 | 2 | 3 | 4 |
| n(H2O)/mol | 0.600 | 0.520 | 0.450 | 0.350 | 0.350 |
| n(CO)/mol | 0.400 | 0.320 | 0.250 | 0.150 | 0.150 |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向水中加入少量的CH3COONa | B. | 向水中加入少量的NaHSO4 | ||
| C. | 加热水至100℃,pH=6 | D. | 向水中加少量的明矾 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com