
分析 根据c(OH-)=$\frac{{K}_{w}}{c(O{H}^{-})}$计算出溶液中氢离子浓度;溶液稀释10倍,溶液中氢离子浓度变为原先的$\frac{1}{10}$,而氢氧根离子浓度变为原先的10倍;溶液稀释10000倍后,酸溶液不可能变为碱溶液,溶液中c(H+)≈10-7mol/L、c(OH-)≈10-7mol/L.
解答 解:常温下,在浓度为10-4mol/L的盐酸溶液中,c(OH-)=$\frac{1{0}^{-14}}{1{0}^{-4}}$mol/L=10-10mol/L;
将该盐酸稀释10倍后,溶液中氢离子浓度为:c(H+)=10-4mol/L×$\frac{1}{10}$=10-5mol/L,c(OH-)=$\frac{1{0}^{-14}}{1{0}^{-5}}$mol/L=10-9mol/L;
将上述溶液稀释10000倍,计算出的氢离子浓度为:c(H+)=10-4mol/L×$\frac{1}{10000}$=10-8mol/L,由于溶液中存在大量电离平衡,则此时溶液中
c(H+)≈10-7mol/L、c(OH-)≈10-7mol/L,
故答案为:10-10;10-5;10-9;10-7;10-7.
点评 本题考查了溶液pH的计算、物质的量浓度的计算,题目难度中等,注意掌握溶液酸碱性与溶液pH的关系及计算方法,明确酸溶液稀释后不可能变为碱溶液,溶液中氢离子浓度只能无限接近10-7mol/L.


 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案科目:高中化学 来源: 题型:选择题
| A. | Na+、Ca2+、N03-、C032- | B. | Ba2+、K+、HC03-、Al02- | ||
| C. | Na+、NH4+、Cl0-、0H- | D. | Mg2+Al3+、Cl-、S042- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | BaO2、NaCl、LiH 三种物质阳离子与阴离子个数比均为:1:1 | |
| B. | CCl4、NH3、PCl3中所有原子都满足最外层为8电子结构 | |
| C. | 甲烷可与溴水发生取代反应,乙烯可与溴水发生加成反应 | |
| D. | 燃料电池是通过燃烧所释放的热能再转化为电能的装置 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 棉花、蚕丝和锦纶的主要成分是纤维素 | |
| B. | 油脂在空气中完全燃烧生成二氧化碳和水 | |
| C. | 苯、乙醇和乙酸都能发生取代反应 | |
| D. | 淀粉和纤维素的组成通式为(C6H10O5)n,二者互为同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 两者都能形成酸雨 | B. | 两者都能与NaOH溶液反应 | ||
| C. | 两者都既有氧化性,又有还原性 | D. | 两者与水反应都生产强酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
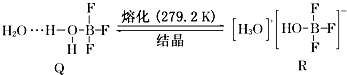
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
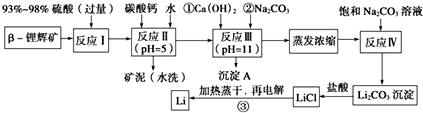
| 氢氧化物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
| 开始沉淀pH | 2.7 | 3.7 | 9.6 |
| 完全沉淀pH | 3.7 | 4.7 | 11 |
| 温度/℃ | 0 | 10 | 20 | 50 | 75 | 100 |
| Li2CO3的溶解度/g | 1.539 | 1.406 | 1.329 | 1.181 | 0.866 | 0.728 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.01 | 0.008 | 0.007 | 0.007 | 0.007 |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com