
| A.用铜片(必要时可加热)鉴别浓硝酸、稀硝酸、浓硫酸和浓盐酸 |
| B.用品红溶液鉴别乙醛、苯、硝基苯 |
| C.用10mL量筒准确量取8.00mL1mol/L的KMnO4溶液 |
| D.用核磁共振氢谱图鉴别乙醇和甲醚 |
科目:高中化学 来源:不详 题型:单选题
| A.①④⑥ |
| B.③⑤⑦ |
| C.②④⑤ |
| D.②⑥⑦ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
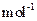 :MnCO3 115 MnO2 87 MnO 71)
:MnCO3 115 MnO2 87 MnO 71)查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
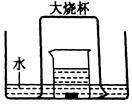
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
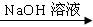 测定剩余固体质量
测定剩余固体质量

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
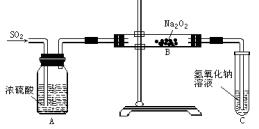

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 物质 | 杂质 | 试剂 | 主要操作 | |
| A | SiO2 | CaCO3 | 盐酸 | 过滤 |
| B | NaHCO3 | Na2CO3 | 盐酸 | 加热 |
| C | Fe | Al | 氢氧化钠 | 分液 |
| D | Fe(NO3)2 | Ba(NO3)2 | 硫酸 | 过滤 |
| A.A | B.B | C.C | D.D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com