
 营养均衡有利于身体健康.某品牌高钙梳打的配料标签如图所示.
营养均衡有利于身体健康.某品牌高钙梳打的配料标签如图所示. 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 现象 | 结论 |
| A | 向某溶液中滴加氯水后再加入KSCN溶液 | 溶液呈红色 | 溶液中一定含有Fe2+ |
| B | 等体积pH=3的HA和HB两种酸分别与足量的锌反应 | 相同时间内HA与Zn反应生成的氢气更多 | HA是强酸 |
| C | 加热盛有NH4Cl固体的试管, | 试管底部固体消失,试管口有晶体凝结 | NH4Cl固体可以升华 |
| D | 向NaBr溶液中滴入少量氯水和苯,振荡、静置, | 溶液上层呈橙红色 | Br-还原性强于Cl- |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHSO3溶液显酸性是因为:HSO3-+H2O?SO32-+H3O+ | |
| B. | 尼泊金酸(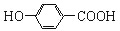 )与碳酸氢钠溶液反应: )与碳酸氢钠溶液反应: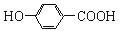 +2HCO3-→ +2HCO3-→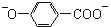 +CO2↑+2H2O +CO2↑+2H2O | |
| C. | KAl(SO4)2溶液中加入少量氢氧化钠溶液:Al3++3OH-═Al(OH)3↓ | |
| D. | 足量硫酸氢钠溶液与氢氧化钡溶液混合:2H++SO42-+Ba2++2OH-═BaSO4↓+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 其中含有的化学键的类型离子键、共价键
其中含有的化学键的类型离子键、共价键查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由乙酸和乙醇制乙酸乙酯;由苯甲酸乙酯水解制苯甲酸和乙醇 | |
| B. | 由甲苯硝化制对硝基甲苯;由甲苯氧化制苯甲酸 | |
| C. | 由氯代环己烷消去制环己烯;由丙烯加溴制1,2二溴丙烷 | |
| D. | 由溴丙烷水解制丙醇;由丙烯与水反应制丙醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
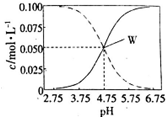 室温条件下在醋酸、醋酸钠混合溶液中,当c(CH3COOH)+c(CH3COO-)=0.lmol.L-1时,c(CH3COOH)、c(CH3COO-)与pH的关系如图所示.下列有关叙述正确的是( )
室温条件下在醋酸、醋酸钠混合溶液中,当c(CH3COOH)+c(CH3COO-)=0.lmol.L-1时,c(CH3COOH)、c(CH3COO-)与pH的关系如图所示.下列有关叙述正确的是( )| A. | pH=5.5的溶液中:c(CH3COOH)>c(CH3COO-)>c(H+)>c(OH-) | |
| B. | 向W点所表示的1.0L溶液中通人0.05molHCl气体(溶液体积变化可忽略):c(H+)=c(CH3COOH)+c(OH-) | |
| C. | W点所表示的溶液中:c(Na+)+c(H+)=c(CH3COOH)+c(OH)- | |
| D. | pH=3.5的溶液中:c(Na+)+c(H+)+c(OH-)+c(CH3COOH)=0.1mol.L-l |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
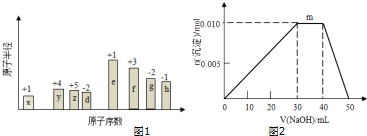
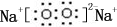 ,0.10mol该化合物与足量水反应时转移的电子数为6.02×1022.
,0.10mol该化合物与足量水反应时转移的电子数为6.02×1022.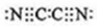 ,(yz)2称为拟卤素,性质与卤素类似,其与氢氧化钠溶液反应的化学方程式是2NaOH+(CN)2=NaCN+NaCNO+H2O.
,(yz)2称为拟卤素,性质与卤素类似,其与氢氧化钠溶液反应的化学方程式是2NaOH+(CN)2=NaCN+NaCNO+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com