
| A. | 氯化钙的化学式:CaCl | B. | HCl分子的电子式: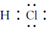 | ||
| C. | 氯化钠的电子式: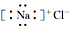 | D. | 氯原子的结构示意图: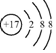 |
分析 A、表示物质的元素组成的式子是化学式;
B、HCl中H原子和Cl原子以共价键相结合;
C、氯化钠是离子化合物,钠离子和氯离子以离子键相结合;
D、氯原子的核外有17个电子.
解答 解:A、表示物质的元素组成的式子是化学式,故氯化钙的化学式为CaCl2,故A错误;
B、HCl中H原子和Cl原子以共价键相结合,中间有一对共用电子对,故HCl的电子式为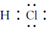 ,故B正确;
,故B正确;
C、NaCl为离子化合物,由钠离子与氯离子构成,电子式为: ,故C错误;
,故C错误;
D、氯原子的核外有17个电子,最外层有7个电子,故原子结构示意图为 ,故D错误.
,故D错误.
故选B.
点评 本题考查了常见的化合物的化学式和共价化合物、离子化合物电子式的书写,难度不大,应注意先区分物质中化学键的类别然后再书写电子式.


科目:高中化学 来源: 题型:解答题

 +nCH3OH$→_{△}^{浓H_{2}SO_{4}}$
+nCH3OH$→_{△}^{浓H_{2}SO_{4}}$ +2nH2O.
+2nH2O. $?_{△}^{催化剂}$
$?_{△}^{催化剂}$ +2nCH3OH.
+2nCH3OH.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHCO3 | B. | NaAl(OH)2CO3 | C. | Mg(OH)2 | D. | BaCO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| t/min | 2 | 4 | 7 | 9 |
| n(Y)/mol | 012 | 011 | 010 | 010 |
| A. | 反应前2min的平均速率v(Z)=2.0×10-5 mol•L-1•min-1 | |
| B. | 其他条件不变,降低温度,反应达到新平衡前:v(逆)>v(正) | |
| C. | 该温度下此反应的平衡常数:K=1.44 | |
| D. | 保持其他条件不变,起始时向容器充入0.32 mol气体X和0.32mol气体Y,到达平衡时,n(Z)=0.024mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
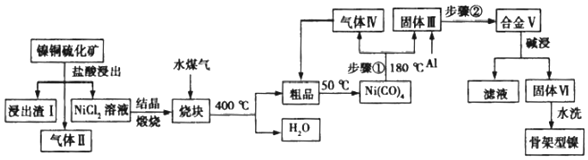
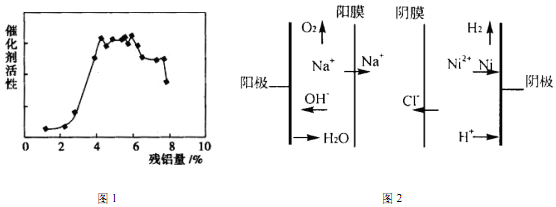
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 质量数为35的氯原子:${\;}_{35}^{17}$Cl | |
| B. | NH4Cl的电子式: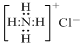 | |
| C. | NaHCO3的水解:HCO3-+H2O?CO32-+H3O+ | |
| D. | 天然橡胶的结构简式: |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
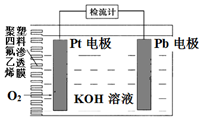 电池式氧传感器原理构造如图,可测定O2的含量.工作时铅极表面会逐渐附着Pb(OH)2.下列说法不正确的是( )
电池式氧传感器原理构造如图,可测定O2的含量.工作时铅极表面会逐渐附着Pb(OH)2.下列说法不正确的是( )| A. | Pt电极上发生还原反应 | |
| B. | 随着使用,电解液的pH逐渐减小 | |
| C. | a mmolO2反应,理论上可使Pb电极增重68a mg | |
| D. | Pb电极上的反应式为Pb+2OH--2e-=Pb(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解质为NaCl溶液,正极反应为H2+2e-=2H+ | |
| B. | 电解质为NaOH溶液,正极反应为O2+2e-=2OH- | |
| C. | 电解质为HCl溶液,正极反应为O2+4e-+4H+=2H2O | |
| D. | 电解质为Na2CO3溶液,正极反应为H2+2e-+CO32-=H2O+CO2↑ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com