

分析 (1)①Al能与碱溶液反应生成氢气;碱洗槽液中的铝以偏铝酸盐形式存在,转化Al(OH)3回收,应利用弱酸,防止Al(OH)3溶解;
②阳极发生氧化反应,Al在阳极放电,由题意可知生成Al2O3,由元素守恒可知应有水参加反应,根据电荷守恒有氢离子生成;
废电解液中含有H+、少量Al3+,HCO3-与H+反应使H+浓度减小,产生Al(OH)3沉淀;
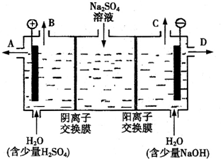
(2)阳极发生氧化反应,水在阳极失去电子生成氧气与氢离子,阴极发生还原反应,水在阴极获得电子生成氢气与氢氧根离子,硫酸钠反应中硫酸根离子通过阴离子交换膜移向阳极室,会得到硫酸,钠离子通过阳离子交换膜移向阴极室,会得到NaOH,根据电荷守恒判断通过阴离子交换膜的离子数与通过阳离子交换膜的离子数关系.
解答 解:(1)①碱洗时常有气泡冒出,是因为铝能与强碱反应产生氢气,反应离子方程式为:2Al+2OH-+2H2O=2AlO2-+3H2↑,碱洗槽液中的铝以偏铝酸盐形式存在,转化Al(OH)3回收,应利用弱酸,防止Al(OH)3溶解,可以向溶液中通入CO2,
故答案为:2Al+2OH-+2H2O═2AlO2-+3H2↑;b;
②阳极发生氧化反应,Al在阳极放电,由题意可知生成Al2O3,由元素守恒可知应有水参加反应,根据电荷守恒有氢离子生成,阳极电极反应式为:2Al+3H2O-6e-═Al2O3+6H+,
加入NaHCO3溶液后产生气泡和白色沉淀,是由于废电解液中含有Al3+,和HCO3-发生了互促水解.或HCO3-与H+反应使H+浓度减小,产生Al(OH)3沉淀,
故答案为:2Al+3H2O-6e-═Al2O3+6H+;HCO3-与H+反应使H+浓度减小,产生Al(OH)3沉淀;
(2)阳极发生氧化反应,水在阳极失去电子生成氧气与氢离子,阴极发生还原反应,水在阴极获得电子生成氢气与氢氧根离子,硫酸钠反应中硫酸根离子通过阴离子交换膜移向阳极室,会得到硫酸,钠离子通过阳离子交换膜移向阴极室,会得到NaOH.
①该电解槽的阳极反应式为:4OH--4e-=2H2O+O2↑,硫酸根离子通过阴离子交换膜移向阳极室,钠离子通过阳离子交换膜移向阴极室,所以通过相同电量时,通过阴离子交换膜的离子数小于通过阳离子交换膜的离子数.
故答案为:4OH--4e-=2H2O+O2↑;小于;
②阴极室是放电生成氢气,同时得到NaOH,气体从上口C放出,则NaOH溶液从D口流出,
故答案为:D.
点评 本题考查化学工艺流程与电解原理应用,关键是明确原理,侧重考查学生信息获取与知识迁移应用能力,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 甲苯与氯气在光照下反应主要生成2,4-二氯甲苯 | |
| B. | 苯和浓硝酸、浓硫酸共热并保持50-60℃反应生成硝基苯 | |
| C. | 甲苯在合适条件下催化加氢可生成甲基环己烷 | |
| D. | 乙烯与溴的四氯化碳溶液反应生成1,2-二溴乙烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
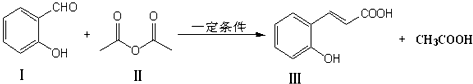
 ,其中反应(1)的条件是氢氧化钠水溶液、加热;
,其中反应(1)的条件是氢氧化钠水溶液、加热;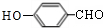 ;
; 也能与化合物Ⅱ发生类似反应①的反应,除CH3COOH外,另一种有机产物的结构简式为
也能与化合物Ⅱ发生类似反应①的反应,除CH3COOH外,另一种有机产物的结构简式为 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe3+、OH-、NO3- | B. | Ca2+、Na+、HCO3- | C. | OH-、Cl-、NH4+ | D. | H+、HCO3-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 浓硫酸可用于干燥Cl2和NH3 | |
| B. | 正常雨水的pH小于7 | |
| C. | CCl4可用于萃取碘水中的碘,但酒精不可以用于萃取碘水中的碘 | |
| D. | Si可用于制造光导纤维 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| CH4 | SiH4 | NH3 | PH3 | |
| 沸点(K) | 101.7 | 161.2 | 239.7 | 185.4 |
| 分解温度(K) | 873 | 773 | 1073 | 713.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将水加热,平衡向正反应方向移动,Kw不变 | |
| B. | 向水中加入少量盐酸,平衡向逆反应方向移动,c(H+)增大 | |
| C. | 向水中加入少量NaOH固体,平衡向逆反应方向移动,c(OH-)降低 | |
| D. | 向水中加入少量Na2CO3固体,平衡向逆反应方向移动,c(OH-)>c(H+) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com