
| A、C4H8O2的同分异构体中能与NaOH反应的有5种 |
| B、等质量的有机物完全燃烧后生成的CO2的量相同,则这两种有机物的实验式一定相同 |
| C、石蜡油分解的实验中,碎瓷片的作用是催化作用和积蓄热量产生高温 |
| D、将甲烷与氯气的混合气体置于密闭容器中放置光亮的地方,一段时间后,装置内的气体有甲烷、氯气、氯化氢、一氯甲烷,二氯甲烷 |


科目:高中化学 来源: 题型:
A、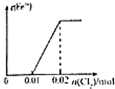 |
B、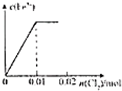 |
C、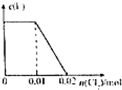 |
D、 |
查看答案和解析>>
科目:高中化学 来源: 题型:
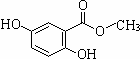 龙胆酸甲酯是制取抗心律失常药物--氟卡尼的中间体.
龙胆酸甲酯是制取抗心律失常药物--氟卡尼的中间体.
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、色谱法通常用于分离结构相近、物理性质和化学性质相似的物质,气相色谱法就是其中一种 |
| B、抽滤完成后若要洗涤沉淀,可以向布氏漏斗中直接加洗涤剂,然后开大水龙头,使洗涤剂迅速通过沉淀 |
| C、提取海带中碘元素时,为保证I-完全被氧化为I2,最好加入过量的氧化剂(H2O2或新制氯水) |
| D、将两块未擦去氧化膜的铝片分别投入1mol?L-1CuSO4溶液、1mol?L-1CuCl2溶液中,静置片刻,铝片表面都观察不到明显的反应现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 为了探究“二氧化碳是否在水存在时才能和过氧化钠反应”,课题研究小组的同学们设计了如图所示的实验装置,分别进行甲、乙两次实验:
为了探究“二氧化碳是否在水存在时才能和过氧化钠反应”,课题研究小组的同学们设计了如图所示的实验装置,分别进行甲、乙两次实验:查看答案和解析>>
科目:高中化学 来源: 题型:
 试回答下列问题:
试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
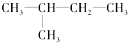 (8)
(8) (9)CH2=CH-CH3(10)
(9)CH2=CH-CH3(10)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com