
等离子体的用途十分广泛,运用等离子体束切割金属或者进行外科手术,利用了等离子体的特点是( )
A.微粒带有电荷 B.高能量
C.基本构成微粒多样化 D.准电中性
科目:高中化学 来源: 题型:
相同温度下,根据三种酸的电离常数,下列判断正确的是( )
| 酸 | HX | HY | HZ |
| 电离常数K | 9×10-7 | 9×10-6 | 10-2 |
A.三种酸的强弱关系:HX>HY>HZ
B.反应HZ+Y-====HY+Z-能够发生
C.相同温度下,0.1 mol·L-1的NaX、NaY、NaZ溶液,NaZ溶液pH最大
D.相同温度下,1 mol·L-1HX溶液的电离常数大于0.1 mol·L-1HX
查看答案和解析>>
科目:高中化学 来源: 题型:
常温时,将V1mLc1mol·L-1的氨水滴加到V2mLc2mol·L-1的盐酸中,下述结论中正确的是( )
A.若混合溶液的pH=7,则c1V1>c2V2
B.若V1=V2,c1=c2,则混合液中c(N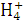 )=c(Cl-)
)=c(Cl-)
C.若混合溶液的pH=7,则混合液中c(N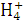 )>c(Cl-)
)>c(Cl-)
D.若V1=V2,且混合溶液的pH<7,则一定有c1<c2
查看答案和解析>>
科目:高中化学 来源: 题型:
如图为一张没有填写内容的元素周期表。
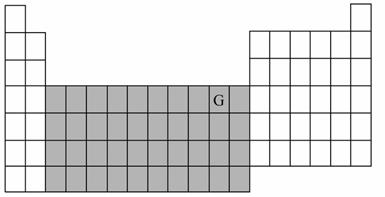
(1) 已知A、B、C、D、E、F六种短周期元素的原子半径和某些化合价如下表所示:
| 元素 | A | B | C | D | E | F |
| 化合价 | -2 | +5、-3 | +4、-4 | +6、-2 | +2 | +1 |
| 原子半径 /nm | 0.074 | 0.075 | 0.077 | 0.102 | 0.160 | 0.186 |
试将B、E两种元素的元素符号填入上图所示周期表中的相应位置。
(2)写出基态G原子的电子排布式:____________________________。
(3) 图中阴影部分所示区域的元素称为___________元素,下列元素属于该区域的是___________。
A.Ba B.Fe C.Br D.Rb
(4)A、B、C三种元素的电离能大小为_________________(填元素符号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
纳米材料是21世纪最有前途的新型材料之一,世界各国对这一新材料给予了极大的关注。纳米粒子是指直径为1~100 nm的超细粒子(1 nm=10-9m)。由于表面效应和体积效应,其常有奇特的光、电、磁、热等性质,可开发为新型功能材料。下列有关纳米粒子的叙述不正确的是( )
A.因纳米粒子半径太小,故不能将其制成胶体
B.一定条件下纳米粒子可催化水的分解
C.一定条件下,纳米TiO2陶瓷可发生任意弯曲,可塑性好
D.纳米粒子半径小,表面活性高
查看答案和解析>>
科目:高中化学 来源: 题型:
(CH3)3NH+和AlCl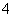 可形成离子液体。离子液体由阴、阳离子组成,熔点低于100℃,其挥发性一般比有机溶剂________(填“大”或“小”),可用作____________(填代号)。
可形成离子液体。离子液体由阴、阳离子组成,熔点低于100℃,其挥发性一般比有机溶剂________(填“大”或“小”),可用作____________(填代号)。
a.助燃剂 b.“绿色”溶剂
c.复合材料 d.绝热材料
查看答案和解析>>
科目:高中化学 来源: 题型:
能正确表示下列反应的离子方程式的是( )
A.硫酸铝溶液中加入过量氨水
Al3++3OH-====Al(OH)3↓
B.碳酸钠溶液中加入澄清石灰水
Ca(OH)2+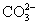 ====CaCO3↓+2OH-
====CaCO3↓+2OH-
C.冷的氢氧化钠溶液中通入氯气
Cl2+2OH-====ClO-+Cl-+H2O
D.稀硫酸中加入铁粉
2Fe+6H+====2Fe3++3H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
同温同压下,某有机物和过量Na反应得到V1 L氢气,取另一份等量的有机物和足量NaHCO3反应得V2 L二氧化碳,若V1=V2 ≠ 0,则该有机物可能是
A.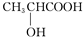 B.HOOC—COOH
B.HOOC—COOH
C.HOCH2CH2OH D.CH3COOH
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA表示阿伏加德罗常数,下列说法正确的是( )
A、1mol氯气参加氧化还原反应,转移的电子数一定为2 NA
B、0.1mol Fe与0.1mol Cl2充分反应,转移的电子数为0.3NA
C、常温常压下,44g二氧化碳分子中所形成的共用电子对数为2 NA
D、常温常压下,1.6gO2和O3混合气体中质子总数为0.8NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com