
在实验室从自来水制取蒸馏水的实验中,下列说法错误的是
A.烧瓶中要放入碎瓷片防止暴沸 
B.温度计的水银球放在支管口附近位置,不能插入液面下
C.冷凝水应该是下进上出,与蒸气的流向相反
D.开始蒸馏时,应该先加热,再开冷凝水;蒸馏完毕,应该先关冷凝水再撤酒精灯
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
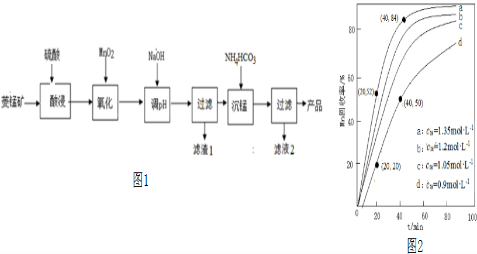
查看答案和解析>>
科目:高中化学 来源:2016-2017学年天津市高二上9月调研化学试卷(解析版) 题型:选择题
下列说法正确的是( )
A.人们把能够发生有效碰撞的分子叫做活化分子,同时把活化分子具有的能量叫活化能
B.化学反应不一定都有能量变化
C.活化能接近于零的反应,当反应物相互接触时,反应瞬间完成,而且温度对其反应速率几乎没有什么影响
D.活化能的大小不仅意味着一般分子成为活化分子的难易,也会对化学反应前后的能量变化产生影响
查看答案和解析>>
科目:高中化学 来源:2016-2017学年天津市高二上9月调研化学试卷(解析版) 题型:选择题
下列说法正确的是( )
A.由单质A转化为单质B是一个吸热过程,由此可知单质B比单质A稳定
B.500℃、30M Pa下,将0.5 mol N2和1.5 mol H2置于密闭容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为:N2(g)+3H2(g)  2NH3(g) ΔH = -38.6 kJ/mol
2NH3(g) ΔH = -38.6 kJ/mol
C.已知热化学方程式:2SO2(g)+O2(g)  2SO3(g) ΔH = -Q kJ/mol ,若将一定量的SO2(g)和O2(g)置于密闭容器中充分反应后放出热量Q kJ,则此过程中有2 mol SO2(g)被氧化
2SO3(g) ΔH = -Q kJ/mol ,若将一定量的SO2(g)和O2(g)置于密闭容器中充分反应后放出热量Q kJ,则此过程中有2 mol SO2(g)被氧化
D.X(g)+Y(g) Z(g) ΔH >0,恒温恒容条件下达到平衡后加入X,上述反应ΔH增大
Z(g) ΔH >0,恒温恒容条件下达到平衡后加入X,上述反应ΔH增大
查看答案和解析>>
科目:高中化学 来源:2016-2017学年陕西省高一上第一次月考化学卷(解析版) 题型:实验题
①容量瓶 ②蒸馏烧瓶 ③蒸发皿 ④量筒
⑤烧杯 ⑥托盘天平 ⑦分液漏斗 ⑧试管
(1)可用于加热但不必垫石棉网的有 。
(2)使用时必须检查是否漏水的是 。
(3)标有零刻度的有 。
II、化学是一门以实验为基础的自然科学,化学实验在化学学习中具有重要作用。下列关于实验的叙述中正确的有___________。
A.不慎碰翻燃着的酒精灯使酒精在桌面上燃烧起来,应立即用湿抺布灭火 |
B.不慎将酸沾到皮肤或衣物上,应立即用浓NaOH溶液清洗 |
C.夜间厨房发生煤气泄漏时,立即开灯检查煤气泄漏原因,并打开所有门窗通风 |
D.用氢气还原氧化铜时,先加热氧化铜,再通入氢气 |
E.可燃性气体点燃前一定要验纯
查看答案和解析>>
科目:高中化学 来源:2016-2017学年陕西省高一上第一次月考化学卷(解析版) 题型:选择题
质量相同的N2和CO,下列物理量不一定相同的是
A.物质的量 B .分子个数 C.原子个数 D.气体体积
.分子个数 C.原子个数 D.气体体积
查看答案和解析>>
科目:高中化学 来源:2016-2017学年陕西省高一上第一次月考化学卷(解析版) 题型:选择题
下列有关气体摩尔体积的说法中正确的是
A.在标准状况下,1 mol任何物质的体积都约为22.4 L
B.在标准状况下 ,0.5 mol任何气体的体积都约为11.2 L
,0.5 mol任何气体的体积都约为11.2 L
C.在常温常压下,1 mol任何气体的体积都约为22.4 L
D.在标准状况下,0.5 mol CCl4所占有的体积约为11.2 L
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
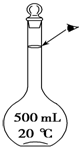 实验室配制500mL 0.5mol•L-1的NaCl溶液,有如下操作步骤:
实验室配制500mL 0.5mol•L-1的NaCl溶液,有如下操作步骤:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com