
【题目】磷化氢(![]() )、氧硫化碳(COS)均可作储粮害虫杀剂。请回答下列问题:
)、氧硫化碳(COS)均可作储粮害虫杀剂。请回答下列问题:
(1)磷原子的核外电子排布式______________,核外有______种不同能量的电子;其最外层有____种运动状态不同的电子,这些电子占据的轨道数为____个。
(2)氧硫化碳中,元素的非金属性最强的元素在周期表中的位置是______;已知COS与![]() 的结构相似,试写出COS的电子式______________,COS属于_____分子(填“极性”或“非极性”)。
的结构相似,试写出COS的电子式______________,COS属于_____分子(填“极性”或“非极性”)。
氧硫化碳水解及部分应用流程如下(部分产物已略去):
COS![]() H2S
H2S![]() Na2S
Na2S![]() M溶液+H2
M溶液+H2
(3)写出反应Ⅱ的离子方程式:_____________________;
(4)硫酸工业生产中接触室内发生的反应方程式为___________;在实际生产中,操作温度选定400~500℃、压强通常采用常压的原因分别是____________。
【答案】1s22s22p63s23p3 5 5 4 第二周期第VIA族 ![]() 极性 H2S+ 2OH- →S2- + 2H2O 2SO2 + O2
极性 H2S+ 2OH- →S2- + 2H2O 2SO2 + O2![]() 2SO3 催化剂在400~500℃时,活性最大,在常压下及400~500℃时,二氧化硫的转化率已经很高,若加压会增加设备、投资和能量消耗
2SO3 催化剂在400~500℃时,活性最大,在常压下及400~500℃时,二氧化硫的转化率已经很高,若加压会增加设备、投资和能量消耗
【解析】
(1)磷的质子数为15,原子的核外电子排布式1s22s22p63s23p3,核外有5种不同能量的电子;各电子的运动状态不同,其最外层有5 个电子,所以5种运动状态不同的电子,这些电子占据的轨道数为1+3=4个;
(2)氧硫化碳中,元素的非金属性最强的元素是氧元素,在周期表中的位置为第二周期第ⅥA族;碳原子与氧原子、硫原子形成2对共用电子对,COS分子电子式为![]() ,COS分子中正负电荷中心不重合;
,COS分子中正负电荷中心不重合;
(3)II是硫化氢与氧氧化钠反应生成硫化钠和水;
(4)从温度对催化剂催化活性影响及压强增大后都设备的要求分析。
(1)磷的质子数为15,原子的核外电子排布式1s22s22p63s23p3,核外有5种不同能量的电子;各电子的运动状态不同,其最外层有5 个电子,所以5种运动状态不同的电子,这些电子占据的轨道数为1+3=4个;
(2)氧硫化碳中,同周期从左到右元素的非金属性增强,同主族从上到下元素的非金属性减弱,元素的非金属性最强的元素是氧元素,O在周期表中的位置为第二周期第ⅥA族;碳原子与氧原子、硫原子形成2对共用电子对,COS分子电子式为![]() ,COS分子中正负电荷中心不重合,所以是极性分子;
,COS分子中正负电荷中心不重合,所以是极性分子;
(3)II是硫化氢与氧氧化钠反应生成硫化钠,硫化氢是弱电解质,反应的离子方程式为:H2S+2OH-→S2-+2H2O;
(4)硫酸工业中,接触室中二氧化硫与氧气催化氧化生成三氧化硫,反应方程式为:2SO2+O2![]() 2SO3;由于催化剂在400~500℃时,活性最大,且在常压下及400~500℃时,二氧化硫的转化率已经很高,若加压会增加设备、投资和能量消耗,所以在实际生产中,操作温度选定400~500℃、压强通常采用常压。
2SO3;由于催化剂在400~500℃时,活性最大,且在常压下及400~500℃时,二氧化硫的转化率已经很高,若加压会增加设备、投资和能量消耗,所以在实际生产中,操作温度选定400~500℃、压强通常采用常压。


 名校联盟快乐课堂系列答案
名校联盟快乐课堂系列答案 黄冈创优卷系列答案
黄冈创优卷系列答案科目:高中化学 来源: 题型:
【题目】1-溴丁烷(密度1.2758 g/mL)是重要的有机合成中间体及有机溶剂,可以在实验室里用溴化钠、浓硫酸和1-丁醇为原料,经过如图六步制得。
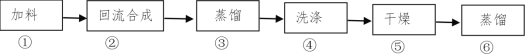
完成下列填空:
(1)通过步骤②获得粗产品,反应的化学方程式是___。此时产品往往呈红棕色,原因是____。实验室里有下列常用试剂,请根据实验需要为与步骤④相关的(2)(3)小题选择试剂,并用试剂编号填空:
a.NaOH溶液 b.NaHCO3溶液 c.NaHSO3 溶液 d.NaBr溶液
(2)产品的红棕色可用___除去(填写试剂编号),相应的离子方程式为___。
(3)选用浓硫酸洗去未反应的1-丁醇和有机副产物,然后除酸。最适宜的除酸试剂是__(填写试剂编号)。
(4)用浓硫酸(密度1.84g/mL)洗涤时,采用___(填写仪器名称)分离出___(填写“上”或“下”)层产物。
(5)检验产物中含有溴元素的实验方法是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D都是中学化学中常见物质,其中A、B、C均含有同一种元素,在一定条件下相互转化关系如下(部分反应中的水已略去)。根据题意回答下列问题:

(1)若A、B、C的焰色反应均为黄色,C为厨房中的用品,D的过度排放会造成温室效应。
①A的化学式______________、B的俗名____________;
②反应II的离子方程式是__________________________________。
(2)若A、D均为单质,且A为气体,D元素的一种红棕色氧化物常用作颜料。
①反应II的离子方程式是_____________________________;
②反应Ⅲ的离子方程式是_____________________________;
③检验B中阳离子最好的方法是_____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关有机物说法不正确的是( )
A. 等质量的苯乙烯和聚苯乙烯燃烧耗氧量相同
B. 四苯基乙烯(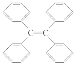 )中所有碳原子一定处于同一平面
)中所有碳原子一定处于同一平面
C. 1 mol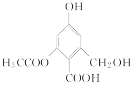 分别与足量的Na、NaOH溶液、NaHCO3溶液反应,消耗这三种物质的物质的量分别是3 mol、4 mol、1 mol
分别与足量的Na、NaOH溶液、NaHCO3溶液反应,消耗这三种物质的物质的量分别是3 mol、4 mol、1 mol
D. 1molβ紫罗兰酮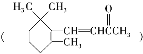 与1molBr2发生加成反应可得3种产物
与1molBr2发生加成反应可得3种产物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮元素的单质和常见的化合物在工、农业生产中用途广泛。
(1)工业上利用分离空气的方法得到氮气.空气各主要成分的沸点如下:
N2 | O2 | Ar | CO2 |
-196℃ | -183℃ | -186℃ | -78℃ |
现将空气深度冷却液化,然后缓慢升温,则最先分离出来的气体是______.
(2)雷雨时空气中的N2转化为NO,生成物NO是______色的气体,______(填“易”或“难”)溶于水;NO在空气中很容易被氧化成NO2,NO2能与水发生化学反应,写出NO2与水反应的化学方程式为__________________.
(3)实验室可用固体NH4Cl与固体Ca(OH)2加热反应制取氨气;
①制取氨气的化学方程式为__________________;
②要制取标准状况下4.48L的氨气,至少需要称取固体NH4Cl的质量为______g;
(4)已知:4NH3+6NO![]() 5N2+6H2O化学研究性学习小组的同学在技术人员的指导下,按下列流程,探究不同催化剂对NH3还原NO反应的催化性能;
5N2+6H2O化学研究性学习小组的同学在技术人员的指导下,按下列流程,探究不同催化剂对NH3还原NO反应的催化性能; ![]()
若控制其他实验条件均相同,在催化反应器中装载不同的催化剂,将经催化反应后的混合气体,通过一定体积滴有酚酞的稀硫酸溶液(溶液的体积、浓度均相同);
①NH3与稀硫酸溶液反应的离子方程式为__________________;
②为了比较不同催化剂的催化性能,需要测量并记录的数据是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组探究氨基甲酸铵(![]() )分解的化学平衡和水解反应速率。将一定量纯净的氨基甲酸铵置于固定容积为100mL的密闭真空溶液A中,在恒定温度下使其达到分解平衡。实验测得不同温度下的平衡数据列于下表:
)分解的化学平衡和水解反应速率。将一定量纯净的氨基甲酸铵置于固定容积为100mL的密闭真空溶液A中,在恒定温度下使其达到分解平衡。实验测得不同温度下的平衡数据列于下表:
温度(℃) | 20.0 | 25.0 | 30.0 | 35.0 |
平衡气体总物质的量(mol) | 0.34 | 0.48 | 0.68 | 0.94 |
①氨基甲酸铵分解的化学方程式为![]() ,若25.0℃时达到平衡所用时间为8min,根据数据计算
,若25.0℃时达到平衡所用时间为8min,根据数据计算![]() 的平均生成速率为________________。
的平均生成速率为________________。
②可以判断该分解反应已经达到化学平衡的是_________。
A.2υ(NH3)正=υ(CO2)逆 B.密闭容器中总压强不变
C. 密闭容器中混合气体的密度不变 D. 密闭容器中氨气的体积分数不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关热化学方程式的叙述中,正确的是 ( )
A.含20.0gNaOH的稀溶液与足量的稀硫酸完全中和,放出28.7kJ的热量,则表示中和热的热化学方程式为:2NaOH(aq)+H2SO4(aq)=Na2SO4(aq)+2H2O(l) H=-114.6kJ/mol
B.已知热化学方程式: SO2(g)+![]() O2(g)
O2(g) ![]() SO3(g) H=-98.32kJ/mol,在容器中充入2mol SO2和1mol O2充分反应,最终放出的热量为196.64kJ
SO3(g) H=-98.32kJ/mol,在容器中充入2mol SO2和1mol O2充分反应,最终放出的热量为196.64kJ
C.已知2H2(g)+O2(g) =2H2O(g)H=-483.6kJ/mol,则H2的燃烧热为241.8kJ/mol
D.用稀氨水与稀盐酸进行中和热的测定实验,计算得到的中和热的H偏大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气的无害化处理已成为当今汽车工业的一项重要课题,其基本原理是实现2NO(g)+2CO(g) ![]() N2(g)+2CO2(g)的反应。关于该反应,下列说法正确的是( )
N2(g)+2CO2(g)的反应。关于该反应,下列说法正确的是( )
A. 只要使用合理的催化剂及载体,就可完全清除NO和CO
B. 使用催化剂只能改变反应的速率不能改变反应的平衡常数
C. 假设该反应在密闭容器中进行,一段时间后达到平衡时c(NO)=c(CO)
D. 恒温恒容条件下,通入惰性气体可提高NO转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学课外活动小组为了验证元素非金属性递变规律,设计了如图所示的两套实验方案进行实验探究:
(1)根据方案一装置![]() 如图
如图![]() 回答以下问题:
回答以下问题:
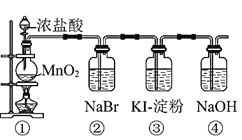
Ⅰ![]() 写出装置①中发生反应的化学方程式:______。
写出装置①中发生反应的化学方程式:______。
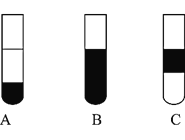
Ⅱ![]() 若将反应后②中的溶液倒入
若将反应后②中的溶液倒入![]() 中,出现的现象与图中吻合的是______。
中,出现的现象与图中吻合的是______。![]() 填代号
填代号![]()
Ⅲ![]() 装置③中的现象是______。
装置③中的现象是______。
(2)根据方案二装置![]() 如图
如图![]() 回答以下问题:
回答以下问题:

Ⅰ![]() 方案二验证元素非金属性递变的理论依据是:______。
方案二验证元素非金属性递变的理论依据是:______。
Ⅱ![]() 装置的作用是______,X是______。
装置的作用是______,X是______。
Ⅲ![]() 能说明碳元素与硅元素非金属性强弱的实验现象是______。
能说明碳元素与硅元素非金属性强弱的实验现象是______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com