
【题目】2SO2(g)+O2(g)![]() 2SO3(g)反应过程中能量变化如图所示(图中E1表示正反应的活化能,E2表示逆反应的活化能。下列有关叙述正确的是
2SO3(g)反应过程中能量变化如图所示(图中E1表示正反应的活化能,E2表示逆反应的活化能。下列有关叙述正确的是
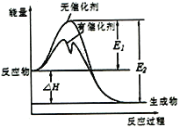
A.该反应的逆反应为放热反应,升高温度可提高活化分子的百分数
B.该反应中,生成物的总键能大于反应物的总键能
C.该反应的反应热为ΔH= E2- E1使用催化剂改变活化能,但不改变反应热
D.500℃、101kPa下,将1molSO2(g)和0.5molO2(g) 置于密闭容器中充分反应生成SO3(g) 放热xkJ,其热化学方程式为2SO2(g)+O2(g)![]() 2SO3(g)ΔH=-2xkJ·mol-1
2SO3(g)ΔH=-2xkJ·mol-1
【答案】B
【解析】
A.由图可知,反应物总能量大于生成物总能量,该反应正反应为放热反应;该反应的逆反应为吸热反应,升高温度可提高活化分子的百分数,A错误;
B.由图可知,反应物总能量大于生成物总能量,该反应正反应为放热反应,其ΔH<0,所以反应物的总键能小于生成物的总键能,故B正确;
C.反应热ΔH=E1-E2,使用催化剂能改变反应的活化能,但不改变反应热,故C错误;
D.500℃、101kPa下,将1molSO2(g)和0.5molO2(g)置于密闭容器中充分反应放热xkJ,由于该反应为可逆反应,得不到1mol SO3(g),所以热化学方程式2SO2(g)+O2(g)![]() 2SO3(g)的反应热的数值不等于2xkJ·mol-l,故D错误;
2SO3(g)的反应热的数值不等于2xkJ·mol-l,故D错误;
故答案选B。


科目:高中化学 来源: 题型:
【题目】某化学小组用胆矾(化学式![]() )配制100mL0.1mol/L的CuSO4溶液。已知胆矾溶于水的过程吸收热量。
)配制100mL0.1mol/L的CuSO4溶液。已知胆矾溶于水的过程吸收热量。
(1)配制该CuSO4溶液所需容量瓶的规格是___。
(2)同学们进行了以下操作,请将空白处填写完整。
①在托盘天平上称得相应质量的胆矾,将其放在___中,加入适量蒸馏水使其溶解。
②待固体全部溶解后,将溶液立即转移到容量瓶中。
③继续向容量瓶中加蒸馏水至液面离瓶颈刻度线下___cm时,改用___滴加蒸馏水至溶液的凹液面与刻度线相切。
④用少量蒸馏水洗涤烧杯和___2~3次,每次洗涤的液体都小心转入相应容器中,并轻轻摇匀。
⑤盖好瓶塞,充分摇匀。
以上操作中有错误的一项是___(填序号,下同),这样操作的结果使所配溶液的浓度___(填“偏大”或“偏小”),将其改正后,配制CuSO4溶液的正确操作顺序是___
(3)取上述溶液10mL稀释至50mL,所得溶液中CuSO4的物质的量浓度为___。
(4)下列有关容量瓶的使用方法中,正确的是___(填字母)。
A. 使用容量瓶前检验是否漏水
B. 固体溶解后直接将溶液沿瓶颈倒入容量瓶中
C. 用食指顶住瓶塞,另一只手托住瓶底,把容量瓶反复颠倒,摇匀
D. 摇匀后容量瓶内液面下降,继续加蒸馏水至刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室以含有Ca2+、Mg2+、Cl-、SO42-、Br-等离子的卤水为主要原料制备无水CaCl2和Br2,流程如下:
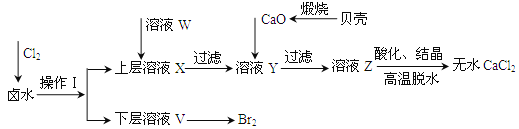
(1)操作Ⅰ使用的试剂是______,所用的主要仪器名称是_____。
(2)加入溶液W的目的是______,用CaO调节溶液Y的pH,可以除去Mg2+,由表中数据可知,理论上可选择的pH最大范围是______,酸化溶液Z时,使用的试剂为______。
开始沉淀时的pH | 沉淀完全时的pH | |
Mg2+ | 9.6 | 11.0 |
Ca2+ | 12.2 | c(OH-)=1.8molL-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化镁在医药、建筑等行业应用广泛。硫酸镁还原热解制备高纯氧化镁是一种新的探索。以菱镁矿(主要成分为MgCO3,另含少量杂质FeCO3和SiO2等)为原料制备高纯氧化镁的实验流程如下:
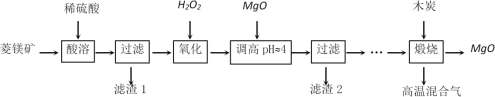
(1)酸溶时,MgCO3与稀硫酸反应的离子方程式为_____________________________。
(2)滤渣1的化学式为__________________。
(3)写出流程中“氧化”的离子方程式为______________________________________。
(4)调节pH时,使用pH试纸的具体操作是取一小块pH试纸放在洁净的玻璃片上,_______________________________________________________;滤渣2中除了过量的MgO外,还含有的物质是____________。
(5)高温煅烧过程中,同时存在以下反应:2MgSO4+C![]() 2MgO+2SO2↑+CO2↑;MgSO4+C
2MgO+2SO2↑+CO2↑;MgSO4+C![]() MgO+SO2↑+CO↑;MgSO4+3C高温MgO+S↑+3CO↑。利用下图装置对煅烧产生的气体进行连续分别吸收或收集(其中S蒸气在A管中沉积)。
MgO+SO2↑+CO↑;MgSO4+3C高温MgO+S↑+3CO↑。利用下图装置对煅烧产生的气体进行连续分别吸收或收集(其中S蒸气在A管中沉积)。
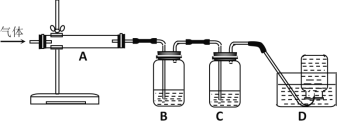
①D中收集的气体是_________________(填化学式)。
②B中盛放的溶液是__________________(填下列选项的字母编号)。
a.NaOH溶液 b.Na2CO3溶液 c.稀硝酸 d.酸性KMnO4溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应 2KMnO4 + 16HCl =2KCl + 2MnCl2 + 5Cl2↑ + 8H2O 可用于实验室制取氯气,
(1)该反应中______是氧化剂,_____是氧化产物,_____元素被还原,
(2)浓盐酸在反应中显示出来的性质是________(填序号)。
①只有还原性 ②还原性和酸性 ③只有氧化性 ④氧化性和酸性
(3)①用双线桥或单线桥标出下列反应的电子转移方向和数目2KMnO4 + 16HCl = 2KCl + 2MnCl2+ 5Cl2↑+ 8H2O_____________________
②在标准状况下,该反应产生2.24 L Cl2时,消耗氧化剂_____mol,被氧化的物质的质量为_____g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是
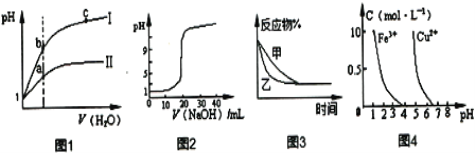
A.图1表示同温度下,pH=1的盐酸和醋酸溶液分别加水稀释时pH的变化曲线,其中曲线II为盐酸,且a点溶液的导电性比b点弱
B.图2表示常温时用0.1000mol·L-1NaOH溶液滴定20.00mL 0.1000mol·L-1CH3COOH溶液所得到的滴定曲线
C.图3表示压强对反应2A(g)+2B(g)![]() 3C(g)+D(s)的影响,乙的压强比甲的压强大
3C(g)+D(s)的影响,乙的压强比甲的压强大
D.据图4,若除去CuSO4溶液中的Fe3+可向溶液中加入适量CuO,调节PH在4左右
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数,则下列叙述中正确的是( )
A.同温同压下,NA个NO气体与NA个N2和O2的混合气体的体积相等
B.标准状况下,22.4LCCl4所含分子数为NA
C.4℃时,9mL水和标准状况下11.2L氮气含有相同的原子数
D.1.7gH2O2中含有的电子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在理论上可用于设计原电池的化学反应是 ( )
A. 2Al(s)十2NaOH(aq)+2H2O(1)=2NaAlO2(ag)+3H2(g);△H <0
B. Ba(OH)2·8H2O(s)+2NH4Cl(s)=BaCl2(aq)+2NH3·H2O(aq)+8H2O(1);△H >0
C. CaC2(s)+2H2O(1)→Ca(OH)2(s)+C2H2(g);△H <0
D. FeCl3(aq)十3H2O(1) ![]() Fe(OH)3(s)+3HCl(aq);△H >0
Fe(OH)3(s)+3HCl(aq);△H >0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是
A. 向![]() 溶液中加入少量氨水:
溶液中加入少量氨水:![]() ==Al(OH)3
==Al(OH)3![]()
B. 向![]() 溶液中加入KOH溶液:HCO3-+OH-═H2O+CO2↑
溶液中加入KOH溶液:HCO3-+OH-═H2O+CO2↑
C. 向![]() 溶液中加入过量的NaOH溶液:
溶液中加入过量的NaOH溶液:![]()
D. 向![]() 溶液中加入过量澄清石灰水:
溶液中加入过量澄清石灰水:![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com