
【题目】(一)(1)用胆矾(CuSO4·5H2O)配制0.200mol/L CuSO4溶液240mL,所需要的玻璃仪器为:烧杯、量筒、________________________(要填全),应称取胆矾的质量为____________。
(2)下列操作使所配CuSO4溶液浓度偏低的是____________。
A.观察刻度线时仰视
B.观察刻度线时俯视
C.定容后倒转容量瓶几次,发现液面最低点低于标线,再补几滴水至标线
D.配制溶液前,容量瓶中有少量蒸馏水
(二)(1)用单线桥标出该反应的电子转移方向和数目,并回答相关问题:
KClO4+8HCl(浓)=KCl+4Cl2↑+4H2O____________,氧化剂与还原剂的物质的量之比为____________。
(2)配平化学方程式(将化学计量数填于空白处)
_____KMnO4+___FeSO4+___H2SO4=___K2SO4+__MnSO4+__Fe2(SO4)3+__H2O
氧化产物与还原产物的物质的量比为________。
【答案】 250mL容量瓶、胶头滴管、玻璃棒 12.5g A、C 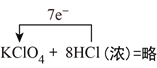 1:7 2KMnO4+10FeSO4+8H2SO4=1K2SO4+2MnSO4+5Fe2(SO4)3+8H2O 5:2
1:7 2KMnO4+10FeSO4+8H2SO4=1K2SO4+2MnSO4+5Fe2(SO4)3+8H2O 5:2
【解析】(一)(1)由于没有240mL容量瓶,则需要配制250mL,因此所需要的玻璃仪器为:烧杯、量筒、250mL容量瓶、胶头滴管、玻璃棒,应称取胆矾的质量为0.25L×0.2mol/L×250g/mol=12.5g。(2)A.观察刻度线时仰视,液面高于刻度线,浓度偏低;B.观察刻度线时俯视液面低于刻度线,浓度偏高;C.定容后倒转容量瓶几次,发现液面最低点低于标线,再补几滴水至标线,溶液体积增加,浓度偏低;D.配制溶液前,容量瓶中有少量蒸馏水不影响,答案选AC。
(二)(1)高氯酸钾中氯元素化合价从+7价降低到0价,氯化氢中氯元素的化合价从-1价升高到0价,所以根据电子得失守恒可知氧化剂与还原剂的物质的量之比为1:7,其中用单线桥标出该反应的电子转移方向和数目为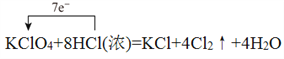 。(2)反应中Mn元素化合价从+7价降低到+2价,得到5个电子。铁元素化合价从+2价升高到+3价,失去1个电子,根据电子得失守恒和原子守恒可知配平后的方程式为2KMnO4+10FeSO4+8H2SO4=K2SO4+2MnSO4+5Fe2(SO4)3+8H2O,其中氧化产物与还原产物的物质的量比为5:2。
。(2)反应中Mn元素化合价从+7价降低到+2价,得到5个电子。铁元素化合价从+2价升高到+3价,失去1个电子,根据电子得失守恒和原子守恒可知配平后的方程式为2KMnO4+10FeSO4+8H2SO4=K2SO4+2MnSO4+5Fe2(SO4)3+8H2O,其中氧化产物与还原产物的物质的量比为5:2。


 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案 激活思维优加课堂系列答案
激活思维优加课堂系列答案科目:高中化学 来源: 题型:
【题目】现有A、B、C、D四种化合物,其焰色反应的火焰均为黄色。其中C是一种淡黄色固体,加热固体A可生成D,同时得到能使澄清石灰水变浑浊的无色气体。A与B溶液混合后可得到D。
(1)写出下列物质的化学式:A、_______;B、_______;C、_______;D、_______。
(2)写出A与B反应的离子方程式:_________________________________________。
(3)在甲、乙、丙、丁四个烧杯中各加入100 mL水,再分别加入0.1 mol 的下列物质:①钠、②氧化钠、③过氧化钠、④氢氧化钠,固体完全溶解后,四个烧杯中溶质的质量分数由大到小的顺序是(填编号)___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】今有一包铁粉和铜粉混合粉末,为确定其组成,现提供4mol/L的FeCl3溶液(其他用品略),某合作学习小组同学的实验结果如下(假定反应前后溶液体积不变)( )
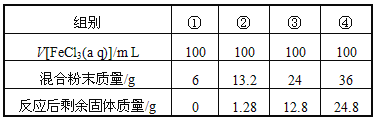
A. 第①组充分反应后溶液中c(Fe3+)=2.0 mol/L
B. 第②组剩余固体是铜铁混合物
C. 第④组反应后的滤液中c(Fe2+)=5 mol/L
D. 原混合粉末中n(Fe):n(Cu)=2:3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关物质转化关系如下图,已知A是一种常见金属,F是一种红褐色沉淀。回答下列问题。

(1)A的化学式为_______;
(2)实验室保存C溶液时需加少量固体A,目的是_____________________。B与盐酸反应的离子方程式为_____________________________。
(3)检验C溶液中阳离子常用的方法是______________________________。
(4)E的浊液在空气中会变质生成F,对应现象为_______________________________ 。
(5)向C中加入Na2O2也可实现C向D和F的转化,Na2O2完全被还原。反应的离子方程式为________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列反应的热化学方程式为:
1)C(s)+O2(g)=CO2(g)△H1=﹣393.5kJ/mol
2)CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l)△H2=﹣870.3kJ/mol
3)H2(g)+ ![]() O2(g)=H2O(l)△H3=﹣285.8kJ/mol
O2(g)=H2O(l)△H3=﹣285.8kJ/mol
则反应2C(s)+2H2(g)+O2(g)=CH3COOH(l) 的反应热(焓变)为( )
A.+488.3kJ/mol
B.﹣488.3kJ/mol
C.﹣244.15kJ/mol
D.+244.15kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】判断下列有关化学基本概念的依据正确的是
A. 溶液与胶体:本质区别是能否发生丁达尔效应
B. 纯净物与混合物:是否仅含有一种元素
C. 物理变化与化学变化:是否有新物质生成
D. 电解质与非电解质:物质本身的导电性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:Ba(OH)2(固态)、CuSO4(固态)、CH3COOH(液态)可以归为一类,则下列物质还可以和它们归为一类的是
A. 75%的酒精溶液 B. 硝酸钠(固态) C. Fe(OH)3 胶体 D. 豆浆
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮及其化合物与生产生活关系密切。请完成下列填空:
(1)肼由N、H 两种元素组成,它常用作火箭推进剂。肼的相对分子质量为32,分子中N、H原子的个数比为1∶2,肼的分子式为_____________。16g 肼分子中所含的氮原子数与标准状况下_______L N2中所含的氮原子数相等。
(2)实验室常用下图所示装置制取并收集氨气。

①实验室制取氨气反应的化学方程式为____________________________________;
②图中方框内收集氨气的装置可选用_________________(填字母序号);
③尾气处理装置中使用倒扣漏斗的作用是_________________________________。
(3)在盛有一定量浓硝酸的试管中加入6.4g的铜片发生反应。请回答下列问题:
①开始阶段,反应的化学方程式为____________________________________,若该反应共产生标准状况下气体2.24L,则反应过程中被还原的HNO3的物质的量为_______。
②反应结束后铜片有剩余,再加入少量20%的稀硫酸,这时铜片上又有气泡产生,反应的离子方程式为____________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在实验过程中,我们往往需要记录一些实验的数据,下列数据可信的是:
A. 某常见气体的密度为2.8 g·cm-3
B. 用托盘天平称出固体的质量为7.85 g
C. 某正常雨水的pH为5.6
D. Ba(OH)2·8H2O晶体与NH4Cl晶体混合搅拌后,测得温度升高5℃
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com