
| A. | 属于置换反应 | |
| B. | 属于氧化还原反应 | |
| C. | 属于离子反应 | |
| D. | 1molFe参加反应失去的电子数为3NA |
科目:高中化学 来源: 题型:选择题
| A. | 硫离子的结构示意图: | |
| B. | 原子核内有10个中子的氧离子:${\;}_{8}^{18}$O | |
| C. | NH4Cl的电子式: | |
| D. | 乙烯的结构简式C2H4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 假说经过反复验证和修正,才发展成为科学的理论 | |
| B. | 研究物质的性质常用观察、实验、分类、比较等方法 | |
| C. | 胶体中分散质微粒能透过滤纸不能透过半透膜 | |
| D. | 依据丁达尔现象可将分散系分为溶液、胶体与浊液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2SO4的摩尔质量(kg/mol)与NA个硫酸分子的质量(g)在数值上相等 | |
| B. | NA个氧气分子和NA个氮气分子的质量比为8:7 | |
| C. | 1.5 L 0.3 mol•L-1Na2SO4溶液中含0.9NA个Na+ | |
| D. | 非标准状况下,22.4LO2中含有氧分子可能为NA个 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
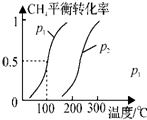 甲醇是一种重要的化工原料,在生产中有着重要的应用.工业上用天然气为原料,分为两阶段制备甲醇:
甲醇是一种重要的化工原料,在生产中有着重要的应用.工业上用天然气为原料,分为两阶段制备甲醇:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com