
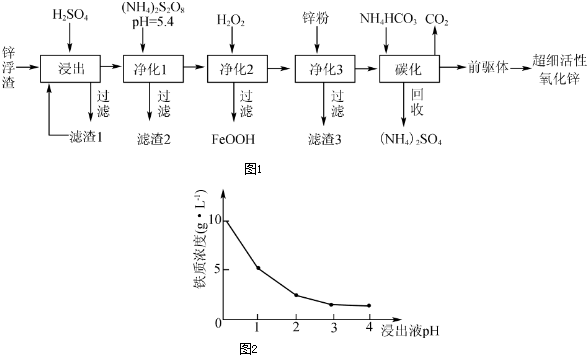
分析 锌浮渣主要含Zn、ZnO、SiO2、Fe2+、Cd2+、Mn2+,加入稀硫酸浸出过滤,得到滤渣Ⅰ为SiO2 ,净化Ⅰ加入(NH4)2S2O8溶液,PH=5.4是为了将Mn2+转化为MnO2而除去,过滤得到滤渣Ⅱ为MnO2,滤液在加入过氧化氢氧化亚铁离子为铁离子,调节溶液PH沉淀铁离子生成FeOOH,过滤得到滤液中加入锌置换铬,过滤得到的金属位Cd,滤液中加入碳酸氢铵碳化,得到硫酸铵和二氧化碳及“前躯体”的化学式为ZnCO3•2Zn(OH)2•H2O,制备得到超细活性氧化锌;
(1)滤渣Ⅰ进行再次浸出的目的是提高锌元素的浸出率;
(2)(NH4)2S2O8溶液,PH=5.4是为了将Mn2+转化为MnO2而除去,发生氧化还原反应;
(3)依据铁离子水解显酸性分析,氢离子浓度大有利于抑制铁离子的水解;
(4)上述分析可知滤渣3为被还原出的Cd;
(5)依据“前躯体”的化学式为ZnCO3•2Zn(OH)2•H2O,结合反应物为硫酸锌和碳酸氢铵,利用原子守恒配平书写化学方程,碳化时所用NH4HCO3的实际用量为理论用量的1.1倍,其原因一是为了使Zn2+充分沉淀,碳酸氢铵受热分解损失.
解答 解:由工业生产流程可知,锌浮渣主要含Zn、ZnO、SiO2、Fe2+、Cd2+、Mn2+,加入稀硫酸浸出过滤,得到滤渣Ⅰ为SiO2 ,净化Ⅰ加入(NH4)2S2O8溶液,PH=5.4是为了将Mn2+转化为MnO2而除去,过滤得到滤渣Ⅱ为MnO2,滤液在加入过氧化氢氧化亚铁离子为铁离子,调节溶液PH沉淀铁离子生成FeOOH,过滤得到滤液中加入锌置换铬,过滤得到的金属位Cd,滤液中加入碳酸氢铵碳化,得到硫酸铵和二氧化碳及“前躯体”的化学式为ZnCO3•2Zn(OH)2•H2O,制备得到超细活性氧化锌;
(1)锌浮渣利用硫酸浸出后,滤渣Ⅰ进行再次浸出的目的是提高锌元素的浸出率;
故答案为:提高锌元素的总浸出率;
(2)(NH4)2S2O8溶液具有氧化性,在PH=5.4时是为了将Mn2+转化为MnO2而除去,发生氧化还原反应,反应的离子方程式为:Mn2++S2O82-+2H2O=MnO2↓+2SO42-+4H+;
故答案为:Mn2++S2O82-+2H2O=MnO2↓+2SO42-+4H+;
(3)90℃时,净化2溶液中残留铁的浓度受pH影响如图2pH值较小时,虽有利于Fe2+转化为Fe3+,但残留铁的浓度仍高于pH为3~4时的原因是,依据铁离子水解显酸性可知,氢离子浓度大有利于抑制铁离子的水解;
故答案为:H+抑制Fe3+水解;
(4)上述分析可知发生Zn+Cd2+=Zn2++Cd,滤渣3为被还原出的Cd,故答案为:Cd;
(5)“前躯体”的化学式为ZnCO3•2Zn(OH)2•H2O,结合反应物为硫酸锌和碳酸氢铵,滤液中加入碳酸氢铵碳化,得到硫酸铵和二氧化碳及“前躯体”的化学式为ZnCO3•2Zn(OH)2•H2O,利用原子守恒配平书写化学方程为:3ZnSO4+6NH4HCO3=ZnCO3•2Zn(OH)2•H2O↓+3(NH4)2SO4+5CO2↑,碳化时所用NH4HCO3的实际用量为理论用量的1.1倍,其原因一是为了使Zn2+充分沉淀,碳酸氢铵受热分解损失或NH4HCO3消耗H+,避免H+浓度过大溶解ZnCO3•2Zn(OH)2•H2O,
故答案为:3ZnSO4+6NH4HCO3=ZnCO3•2Zn(OH)2•H2O↓+3(NH4)2SO4+5CO2↑;碳酸氢铵受热分解损失或NH4HCO3消耗H+,避免H+浓度过大溶解ZnCO3•2Zn(OH)2•H2O.
点评 本题考查了物质提纯和分离的工业制备流程分析判断,实验过程的分析应用,主要是物质性质的理解应用,掌握基础是关键,题目难度较大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
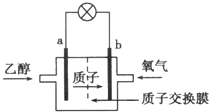 在2004年美国圣路易斯大学研制了一种新型的乙醇电池,它用磺酸类质子溶剂,在200℃左右时供电,乙醇电池比甲醇(CH3OH)电池效率高出32倍,且更安全.电池总反应为:C2H5OH+3O2=2CO2+3H2O,电池示意图如图所示,下列说法中正确的是( )
在2004年美国圣路易斯大学研制了一种新型的乙醇电池,它用磺酸类质子溶剂,在200℃左右时供电,乙醇电池比甲醇(CH3OH)电池效率高出32倍,且更安全.电池总反应为:C2H5OH+3O2=2CO2+3H2O,电池示意图如图所示,下列说法中正确的是( )| A. | a极为电池的正极 | |
| B. | 电池工作时电子由b极沿导线经灯泡再到a极 | |
| C. | 电池正极的电极反应为:4H++O2+4e-=2H2O | |
| D. | 电池工作时,1 mol乙醇被氧化时就有6 mol电子转移 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫酸是铅蓄电池的电解质溶液,铅蓄电池可实现化学能转变成电能 | |
| B. | 硅酸干凝胶是硅酸干燥剂的主要成分,作用是吸收水分 | |
| C. | 肥皂的主要成分是硬脂酸钠,可以用于除去油污 | |
| D. | 二氧化硅是光能转化为电能的转化材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| t/s | 0 | 3 | 6 | 12 | 24 |
| n(O2)/mol | 0 | 0.36 | 0.60 | 0.80 | 0.80 |
| A. | 反应在0~3s的平均速率为v(NO2)=0.24mol•L-1•s-1 | |
| B. | 24s后,若保持其他条件不变,降低温度,达到新平衡时测得c(O2)=0.44mol•L-1,则反应的△H<0 | |
| C. | 在T温度下,起始时向容器中充入1.0molNO2、0.5molO3和0.50molN2O5、0.50molO2,反应达到平衡时,压强为起始的0.88倍 | |
| D. | 在T温度下,起始时向容器中充入2.0molN2O5和2.0molO2,达到平衡时,N2O5的转化率大于20% |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com