
分析 (1)设盐酸、NaOH溶液体积分别为3V、2V,常温下,将0.05mol/L盐酸溶液和浓度0.1mol/L的NaOH溶液以3:2的体积比混合,n(H+)=3VL×0.05mol/L,n(OH-)=2VL×0.1mol/L,碱过量,反应后溶液呈碱性,根据Kw=c(H+)×c(OH-),计算反应后c(H+),可计算pH;
(2)NaA为强碱弱酸盐溶液呈碱性,若用上述NaOH溶液与某一元弱酸HA溶液反应,已知反应后的溶液pH=6,说明溶液呈酸性,即溶液中的溶质是NaA和HA,根据电荷守恒守恒判断.
解答 解:(1)设盐酸、NaOH溶液体积分别为3V、2V,0.05mol/L盐酸溶液n(H+)=3VL×0.05mol/L,0.1mol/L的NaOH溶液n(OH-)=2VL×0.1mol/L,混合,碱过量,则反应后c(OH-)=$\frac{2VL×0.1mol/L-3VL×0.05mol/L}{5VL}$=0.01mol/L,Kw=c(H+)×c(OH-),c(H+)=$\frac{1×1{0}^{-14}}{1×1{0}^{-2}}$=1×10-12,pH=-lgc(H+),pH=12,
故答案为:12;
(2)NaA为强碱弱酸盐溶液呈碱性,反应后的溶液pH=6,说明溶液中的溶质是NaA和HA,溶液中存在电荷守恒c(Na+)+c(H+)=c(OH-)+c(A-),c(A -)-c(Na+)=c(H+)-c(OH-)=10-6-$\frac{1{0}^{-14}}{1{0}^{-6}}$=9.9×10-7,
故答案为:9.9×10-7.
点评 本题考查了酸碱混合后的溶液的pH的计算,题目难度中等,判断溶液中的过量离子是解题关键,注意掌握酸碱反应后溶液的pH的计算方法.


 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:选择题
| A. | 硬水使肥皂去污能力减弱是因为发生了沉淀反应 | |
| B. | 用热的纯碱溶液可区别植物油和矿物油 | |
| C. | 从溴水中提取溴可用植物油作萃取剂 | |
| D. | 生产盐酸和人造脂肪必须用氢气作原料 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=2 的CH3COOH溶液 | B. | 0.01 mol/L Na2CO3溶液 | ||
| C. | 0.001 mol/L盐酸 | D. | pH=10氨水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 充电过程是化学能转化为电能的过程 | |
| B. | 充电时阳极反应为Cd(OH)2+2e-═Cd+2OH - | |
| C. | 放电时电池内部OH-向正极移动 | |
| D. | 充电时与直流电源正极相连的电极上发生Ni(OH)2转化为NiO(OH)的反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 通入NO2:Na+、Fe2+、C1-、SO42- | B. | 通入NH3:AlO2-、NH4+、Na+、NO3- | ||
| C. | 通入Cl2:K+、NH4+、I-、C1- | D. | 通入CO2:Na+、K+、NO3-、SiO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一氧化碳通过灼热的氧化铁 | B. | 氧化铝溶于盐酸 | ||
| C. | 过氧化钠固体中通人水蒸气 | D. | 氢氧化亚铁露置在空气中 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
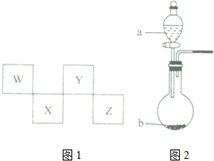 W、X、Y、Z四种短周期元素在周期表中的位置如图1所示,其中Y与钠元素和氢元素均可形成原子个数1:1和1:2的化合物.
W、X、Y、Z四种短周期元素在周期表中的位置如图1所示,其中Y与钠元素和氢元素均可形成原子个数1:1和1:2的化合物. ,Z在周期表中的位置第三周期ⅦA族.
,Z在周期表中的位置第三周期ⅦA族.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com