
| ������ | Fe��OH��3 | Fe��OH��2 | Co��OH��2 | Al��OH��3 | Mn��OH��2 |
| ��ʼ���� | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| ��ȫ���� | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
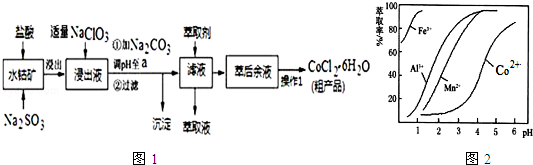
���� ���ܷ����м������ᣬ����������������ƣ��ɵ�CoCl2��AlCl3��FeCl2������NaClO3���ɵõ�FeCl3��Ȼ�����Na2CO3��pH��5.2���ɵõ�Fe��OH��3��Al��OH��3���������˺�������Һ��Ҫ����CoCl2��Ϊ�õ�CoCl2•6H2O���壬Ӧ�����¶���86�����£�����ʱҪ��ֹ�¶ȹ��߶�ʧȥ�ᾧˮ���ɼ�ѹ��ɣ�
��1���������ƾ��л�ԭ�ԣ��ܻ�ԭ���������ӣ�
��2��NaClO3�������ǽ�Fe2+������Fe3+�������������£�NaClO3�������ӷ���������ԭ��Ӧ����������
��3�����������ӡ�����������̼������ӷ���˫ˮ�����ɳ����Ͷ�����̼���н��
��4�����ݴ���Һ����ȡ����ķ�����ȡ�Ȼ��ܹ��壬�Ӷ�ȷ���������裻�¶ȸ�ʱ��CoCl2•6H2O�ֽ⣻
��5���ɱ������ݿ�֪��������ҺPH��3.0��3.5֮�䣬��ʹMn2+��ȫ����������ֹCo2+ת��ΪCo��OH��2������
��6������AgCl��������Ϊ4.6g���ɼ���ôֲ�Ʒ��CoCl2•6H2O���������ݴ˼���ֲ�Ʒ��CoCl2•6H2O������������
��� �⣺���ܷ����м������ᣬ����������������ƣ��ɵ�CoCl2��AlCl3��FeCl2������NaClO3���ɵõ�FeCl3��Ȼ�����Na2CO3��pH��5.2���ɵõ�Fe��OH��3��Al��OH��3���������˺�������Һ��Ҫ����CoCl2��Ϊ�õ�CoCl2•6H2O���壬Ӧ�����¶���86�����£�����ʱҪ��ֹ�¶ȹ��߶�ʧȥ�ᾧˮ���ɼ�ѹ��ɣ�
��1���������ƾ��л�ԭ�ԣ��ܻ�ԭ����������Fe3+��Co3+�����Խ��������м���Na2SO3��Ŀ���ǽ�Fe3+��Co3+��ԭ��
�ʴ�Ϊ����Fe3+��Co3+��ԭ��
��2��NaClO3�������ǽ�Fe2+������Fe3+���䷴Ӧ�����ӷ���ʽΪ��ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O�������������£�NaClO3�������ӷ���������ԭ��Ӧ�����������䷴Ӧ�����ӷ���ʽΪ��ClO3-+5Cl-+6H+=3Cl2��+3H2O��
�ʴ�Ϊ��ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O��ClO3-+5Cl-+6H+=3Cl2��+3H2O��
��3��NaClO3�������ǽ�Fe2+������Fe3+����Na2CO3��pH��a��Ϊʹ�����ӳ�����ȫ���������Ӳ����������ݱ������ݿ�֪pHֵ�ķ�Χ��5.2��a��7.6������������̼������ӷ���˫ˮ���������������Ͷ�����̼��ˮ������ӷ���ʽΪ��2Al3++3CO32-+3H2O=2Al��OH��3��+3CO2��������������̼������ӷ���˫ˮ���������������Ͷ�����̼��ˮ������ӷ���ʽΪ��2Fe3++3CO32-+3H2O=2Fe��OH��3��+3CO2�������Գ����ɷ�Ϊ��Fe��OH��3��Al��OH��3��
�ʴ�Ϊ��5.2��a��7.6��Fe��OH��3��Al��OH��3��
��4�����ô���Һ����ȡ����ķ�����ȡ�Ȼ��ܹ��壬���������Ϊ������Ũ������ȴ�ᾧ���ˣ�
��������֪��CoCl2•6H2O�������ȶ�����������110��120��ʱ��ʧȥ�ᾧˮ����ж�����ˮ�Ȼ��ܣ�Ϊ��ֹ��ֽ⣬�Ƶõ�CoCl2•6H2O���ѹ��ɣ�
�ʴ�Ϊ������Ũ������ȴ�ᾧ�����ͺ���¶ȣ���ֹ��Ʒ�ֽ⣻
��5����������ͼ��֪����ʱ��Һ�д���Mn2+��Co2+�������ӣ�
����ȡ���Խ������ӵ���ȡ����pH�Ĺ�ϵ��֪��������ҺPH��3.0��3.5֮�䣬��ʹMn2+��ȫ����������ֹCo2+ת��ΪCo��OH��2������
�ʴ�Ϊ����ȥ��Һ�е�Mn2+��B��
��6������AgCl��������Ϊ4.6g���ɼ���ôֲ�Ʒ��CoCl2•6H2O������Ϊ$\frac{4.6}{143.5}$��$\frac{1}{2}$����59+71+108��g��$\frac{100}{25}$=15.26g�����Դֲ�Ʒ��CoCl2•6H2O����������Ϊ$\frac{15.26g}{16.4g}$��100%=93.0%��
�ʴ�Ϊ��93.0%��
���� ���⿼�����ʵ��Ʊ�ʵ�飬Ϊ��Ƶ���㣬�����Ʊ�ԭ����ʵ�������еķ�Ӧ���������뷽����Ϊ���Ĺؼ������ط�����ʵ�������Ŀ��飬ע��ˮ�⡢���ӷ�Ӧ�ȣ���Ŀ�Ѷ��еȣ�


 �����������һ��һ��ϵ�д�
�����������һ��һ��ϵ�д� Ӧ������ҵ��ϵ�д�
Ӧ������ҵ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ���ǽ��������в����ܺ��н���Ԫ�� | |
| B�� | ���Ρ������о�ˮ���ã�����ǵ�ˮ�м���������������������Һ�����裬��һ��ʱ�䣬ˮ�ĵײ�����ֺܶ���״�����ˮ������� | |
| C�� | �Ȼ����ڻ�ѧ��ҵ��������ҪӦ�ã�����SiCl4��GeCl4��TiCl4�ֱ�����ȡ�ߴ��衢����ѵ���Ҫ�м����� | |
| D�� | �����ϴ��ڵ���Ȼ����������̬�нᾧ�κ�����������ͳ�ƹ�ʯ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� |  ʵ���������� | B�� |  �ռ����� | ||
| C�� |  �Ʊ������������Ŀ�ȼ�� | D�� | 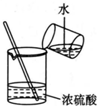 Ũ����ϡ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ���� | B�� | ���� | C�� | ���� | D�� | ����Ũ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��ƶ���
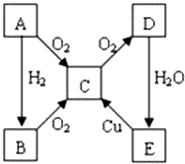 A��B��C��D��E�����ʵ�ת����ϵ��ͼ��ʾ��
A��B��C��D��E�����ʵ�ת����ϵ��ͼ��ʾ�� ��
�� CO2��+2SO2��+2H2O��
CO2��+2SO2��+2H2O��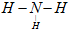 ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
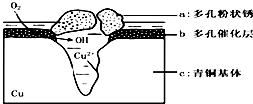 ��ͭ�����������л������Ͷ������ǻ۵Ľᾧ����Ϊһ��ʱ��������������������ͭ������ܵ�������ʴ����ͼΪ��ͭ���ڳ�ʪ�����з����绯ѧ��ʴ��ԭ��ʾ��ͼ�������е� Cl- ��ɢ���ڣ�������缫�����������ɶ��״�� Cu2��OH��3 Cl������˵������ȷ���ǣ�������
��ͭ�����������л������Ͷ������ǻ۵Ľᾧ����Ϊһ��ʱ��������������������ͭ������ܵ�������ʴ����ͼΪ��ͭ���ڳ�ʪ�����з����绯ѧ��ʴ��ԭ��ʾ��ͼ�������е� Cl- ��ɢ���ڣ�������缫�����������ɶ��״�� Cu2��OH��3 Cl������˵������ȷ���ǣ�������| A�� | ��ʴ�����У�����b������ | |
| B�� | �����е�Cl-��ɢ���ڣ�����������Ӧ���������Ӧ�����������ɶ��״��Cu2��OH��3Cl�������ӷ���ʽΪ2Cu2++3OH-+Cl-=Cu2��OH��3Cl�� | |
| C�� | ������ 2.145gCu 2 �� OH��3 Cl�������������ı�״���������Ϊ 0.448L | |
| D�� | �����ĵ缫��ӦʽΪ��������Ӧ�� O2+4e-+2H2O�T4OH-- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��ƶ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
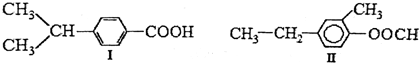
| A�� | �������ʵķ���ʽ��ΪC10H14O2��Ϊͬ���칹�� | |
| B�� | �������ʾ��ܷ����ӳɺ�ȡ����Ӧ | |
| C�� | �������ʶ��м����������Ȼ� | |
| D�� | �����ʶ�����˫����˶���ʹ������Ȼ�̼��Һ��ɫ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com