
分析 (1)由盖斯定律可知,①CH3OH(g)+H2O(g)=CO2(g)+3H2(g)△H1=+49.0kJ•mol-1、③H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-241.8kJ•mol-1,①+③得到反应②;
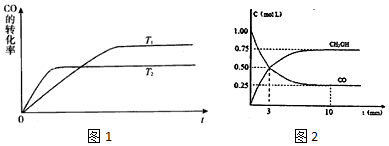
(2)根据先拐先平原则,由图1可知,温度T1<T2,平衡时,温度越高CO的转化率越小,说明升高温度,平衡向逆反应移动,升高温度平衡向吸热反应移动,据此判断反应热,K1与K2关系;
由图2可知,甲醇的浓度变化量为0.75mol/L,根据v=$\frac{△c}{△t}$计算v(CH3OH),再利用速率之比等于化学计量数之比计算v(H2);根据图象计算出反应消耗二氧化碳的浓度,然后计算出二氧化碳的转化率;分别计算出平衡时各组分的浓度,然后利用平衡常数表达式计算出该温度下的平衡常数;
要使$\frac{n(C{H}_{3}OH)}{n(C{O}_{2})}$增大,应使平衡向正反应方向移动.
解答 解:(1)由盖斯定律可知,①CH3OH(g)+H2O(g)=CO2(g)+3H2(g)△H1=+49.0kJ•mol-1、③H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-241.8kJ•mol-1,①+③得到反应②,则△H2=+49.0kJ•mol-1+(-241.8kJ•mol-1)=-192.8kJ•mol-1,
故答案为:-192.8kJ•mol-1;
(2)①根据先拐先平原则,由图1可知,温度T1<T2,平衡时,温度越高CO的转化率越小,说明升高温度,平衡向逆反应移动,升高温度平衡向吸热反应移动,故该反应正反应为放热反应,
故答案为:<;
②平衡时,温度越高CO的转化率越小,说明升高温度,平衡向逆反应移动,升高温度平衡向吸热反应移动,故该反应正反应为放热反应;升高温度,平衡向逆反应移动,所以K1>K2,
故答案为:>;
③由图2可知,10min达平衡时甲醇的浓度变化量为0.75mol/L,所以v(CH3OH)=$\frac{0.75mol/L}{10min}$=0.075mol/(L•min),速率之比等于化学计量数之比,所以v(H2)=3v(CH3OH)=3×0.075mol/(L•min)=0.225mol/(L•min);
平衡时c(CH3OH)=c(H2O)=0.75mol/L,c(CO2)=0.25mol/L,反应消耗二氧化碳浓度为0.75mol/L,则反应消耗氢气浓度为0.75mol/L×3=2.25mol/L,则达到平衡时氢气浓度为:c(H2)=3mol/L-2.25mol/L=0.75mol/L,所以该温度下该反应的平衡常数K=$\frac{0.75×0.75}{0.25×0.7{5}^{3}}$=$\frac{16}{3}$,
故答案为:0.225mol/(L•min);$\frac{16}{3}$.
④要使$\frac{n(C{H}_{3}OH)}{n(C{O}_{2})}$增大,应使平衡向正反应方向移动
A.因正反应放热,升高温度平衡向逆反应方向移动,则n(CH3OH)/n(CO2)减小,故A错误;
B.充入He(g),使体系压强增大,但对反应物质来说,浓度没有变化,平衡不移动,n(CH3OH)/n(CO2)不变,故B错误;
C.再充入1mol CO2和3mol H2,等效于在原来基础上缩小体积一半,压强增大,平衡向正反应方向移动,则n(CH3OH)/n(CO2)增大,故C正确;
D.使用催化剂,平衡不移动,故n(CO)和n(CH3OH)均不变,故D错误;
故答案为:C.
点评 本题为综合题,涉及热化学反应方程式的书写、化学反应速率和平衡移动的影响因素等知识点,注重高考常考考点的考查,题目难度中等.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 3:1 | B. | 1:3 | C. | 2:1 | D. | 7:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+ HCO3- SO42- Br- | B. | Cu2+ K+ SO42- NO3- | ||
| C. | Na+ K+ Cl- NO3- | D. | Fe3+ K+ SO42- Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 营养液所含成分 | 质量(g) |
| KCl | a |
| K2SO | b |
| NH4Cl | 428 |
| A. | 53.5 和214 | B. | 74.5 和348 | C. | 74.5 和696 | D. | 149 和696 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | C | N | O | Ne | ||||
| 3 | Na | Mg | Al | Si | S | Cl |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 实验室需要0.1mol/L NaOH溶液450mL和0.5mol/L硫酸溶液450mL.根据这两种溶液的配制情况回答下列问题:
实验室需要0.1mol/L NaOH溶液450mL和0.5mol/L硫酸溶液450mL.根据这两种溶液的配制情况回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com