

| ||
| ||


 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
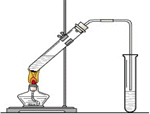 “酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯.回答下列问题
“酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯.回答下列问题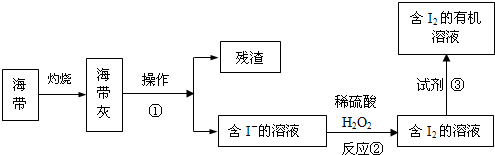
查看答案和解析>>
科目:高中化学 来源: 题型:
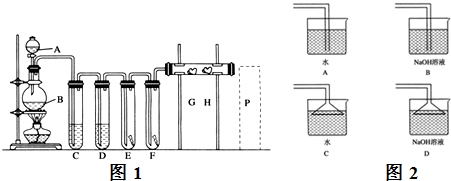
现有三个同学分别设计三套实验装置如下:
(1)请从:a.不容易控制反应速率,b.容易控制反应速率,c.有副反应发生,d.可防止副反应发生,e.污染环境,f.可防止污染环境几个方面对上述甲、乙、丙三套装置的优缺点作出评价,并选择符合题目要求的选项填在空格内。
装置 | 优点 | 缺点 |
甲 |
|
|
乙 |
|
|
丙 |
|
|
(2)图中甲由A、B两部分组成,乙由C、D、E三部分组成,丙由F、G组成,从下述甲、乙、丙三套装置中选出合理的部分(按气流从左到右的方向)组装一套较完善的实验装置(填所选部分的编号):_____________________。
(3)实验中若用12 mol·L-1的浓盐酸100 mL与足量的MnO2反应,最终生成Ca(ClO)2的物质的量总小于0.15 mol,其可能的主要原因是____________________________(假定各步反应均无反应物损耗且无副反应发生)。
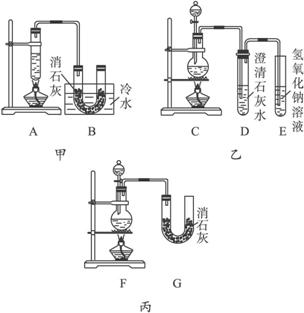
图6-31
查看答案和解析>>
科目:高中化学 来源:2011-2012年黑龙江龙东地区高一下学期期末考试化学试卷(带解析) 题型:实验题
(10分)“酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯。回答下列问题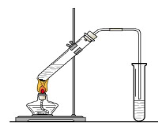
(1)在大试管中按一定比例将乙醇、乙酸混合后充分加热,在右边小试管中未收集到有香味的液体(气密性良好),原因可能是: 。
(2)右边小试管中应加入的试剂是: ;其作用是 。
(3)下列描述能说明乙醇与乙酸的酯化反应已达到该反应的限度的有(填序号) 。
①单位时间里,生成1mol乙酸乙酯,同时生成1mol水
②单位时间里,生成1mol乙酸乙酯,同时生成1mol乙酸
③单位时间里,消耗1mol乙醇,同时消耗1mol乙酸
④正反应的速率与逆反应的速率相等
⑤混合物中各物质的浓度不再变化
(4)海水化学资源的开发利用具有重要的意义和作用,下图是海带中提取碘的示意图: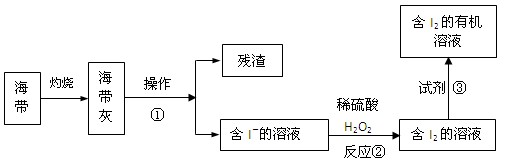
操作①的名称是 ;反应②的离子方程式是 ,下述物质中可做试剂③的是 。
| A.乙醇 | B.苯 | C.乙酸 | D.四氯化碳 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com