
| A、由水电离的c(H+):①=②=③=④ |
| B、等体积的①、②、④溶液分别与足量铝粉反应,生成H2的量:②最大 |
| C、将②、③溶液混合后,若pH=7,则消耗溶液的体积:②>③ |
| D、四种溶液均稀释100倍后,溶液的pH:③>④>②>① |


 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案科目:高中化学 来源: 题型:
| A、将10.6gNa2CO3溶于100mL水中 |
| B、将28.6g Na2CO3?10H2O溶于少量水中,再用水稀释至100mL |
| C、将20mL5.0mol/L Na2CO3溶液用水稀释至100mL |
| D、在20mL5.0mol/L Na2CO3溶液中加入80mL水 |
查看答案和解析>>
科目:高中化学 来源: 题型:
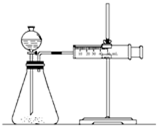 影响化学反应速率的因素很多,某校化学小组用实验的方法进行探究.
影响化学反应速率的因素很多,某校化学小组用实验的方法进行探究.| 实验步骤 | 现象 | 结论 |
| ①分别取等体积的2mol/L的硫酸于试管中 ② | 反应速率Mg>Fe, Cu不反应 | 金属的性质越活泼, 反应速率越快 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、一个可逆反应达到的平衡状态就是这个反应在该条件下所能达到的限度 |
| B、常温下,向Mg(OH)2饱和溶液中加入NaOH溶液,Mg(OH)2的Ksp不变 |
| C、带有“盐桥”的铜锌原电池比不带“盐桥”的铜锌原电池电流持续时间长 |
| D、对滴加酚酞的NaHCO3溶液加热,红色加深,是因为加热时NaHCO3分解生成Na2CO3,碱性增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、图1装置一定可以制得乙烯 |
| B、图2装置可以证明CH3CH2OH发生消去反应生成了乙烯 |
| C、图3所示装置可以证明碳酸酸性强于苯酚 |
| D、实验室常用图4所示装置制取少量的乙酸乙酯 (夹持物略) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、促进、促进、促进 |
| B、抑制、抑制、促进 |
| C、促进、抑制、抑制 |
| D、抑制、促进、抑制 |
查看答案和解析>>
科目:高中化学 来源: 题型:
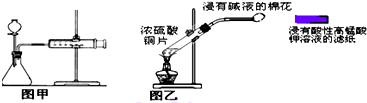
| A、快速分离氢氧化铁胶状沉淀和氯化钠溶液可用抽滤法 |
| B、常温下,苯酚与水形成的浊液静置后会分层,上层为溶有水的苯酚溶液 |
| C、甲装置可用于某些化学反应速率的测定.该装置气密性的检查如下:仪器组装好后,关闭分液漏斗活塞,将针筒活塞向外拉一段距离,然后松手,观察针筒是否能回到原来刻度处 |
| D、乙装置可用来制取和检验二氧化硫气体漂白性,待滤纸颜色褪去后立即用浸有碱液的棉花堵住试管口 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、淀粉和纤维素均可用(C6H10O5)n表示 |
| B、淀粉水解的最终产物能发生银境反应 |
| C、向蛋白质溶液中加入饱和硫酸铵溶液后产生的沉淀能重新溶于水 |
| D、脂肪能溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| ||
| ||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com