
【题目】下表是元素周期表的一部分

(1)表中非金属性最强的元素为__________(填写元素符号)。
(2)写出元素⑦最高价氧化物对应水化物的化学式___________。
(3)表中元素③和⑤可以组成原子比例为1:1的物质,元素②可以组成一种常见的气体单质,请画出两种分子的电子式____________、____________。
(4)表中元素④⑦氢化物的稳定性由大到小的顺序为:__________ (填写化学式)。
(5)表中有一种元素的单质可作为半导体材料,它在元素周期表中的位置是________。
【答案】F HClO4 ![]()
![]() HF>HCl 第三周期ⅣA族
HF>HCl 第三周期ⅣA族
【解析】
由表中元素的位置,可确定①~⑦号元素分别为H、N、O、F、Na、Si、Cl。
(1)在元素周期表中,从左到右,元素的非金属性依次增强;从下往上,元素的非金属性依次增强,所以非金属性最强的元素位于元素周期表的左上角。
(2)元素⑦为Cl,位于第三周期ⅦA族,在最高价氧化物对应水化物中显+7价。
(3)元素③和⑤可以组成原子比例为1:1的物质,则其为Na2O2;元素②可以组成一种常见的气体单质,则其为N2。
(4)元素④⑦氢化物分别为HF、HCl,非金属性越强,其氢化物的稳定性越强。
(5)表中有一种元素的单质可作为半导体材料,它为硅。
(1)在元素周期表中,从左到右,元素的非金属性依次增强;从下往上,元素的非金属性依次增强,所以非金属性最强的元素位于元素周期表的左上角,其为F。答案为:F;
(2)元素⑦为Cl,位于第三周期ⅦA族,在最高价氧化物对应水化物中显+7价,其化学式为:HClO4。答案为:HClO4;
(3)元素③和⑤可以组成原子比例为1:1的物质,则其为Na2O2,电子式为![]() ;元素②可以组成一种常见的气体单质,则其为N2,电子式为
;元素②可以组成一种常见的气体单质,则其为N2,电子式为![]() 。答案为
。答案为![]() ;
;![]() ;
;
(4)元素④⑦氢化物分别为HF、HCl,非金属性越强,其氢化物的稳定性越强,则氢化物的稳定性由大到小的顺序为:HF>HCl。答案为:HF>HCl;
(5)表中有一种元素的单质可作为半导体材料,它为硅,它在元素周期表中的位置是第三周期ⅣA族。答案为:第三周期ⅣA族。


 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案科目:高中化学 来源: 题型:
【题目】SO2的含量是衡量大气污染的一个重要指标。工业上常采用催化还原法、吸收法或电解法处理SO2。利用催化还原 SO2法 不仅可消除SO2污染,而且可得到有经济价值的单质S。
(1)已知CH4和S的燃烧热(△H)分别为-890.3 kJ/ mol和一297.2 kJ/ mol , 则CH4 催化还原SO2反应:CH4(g) +2 SO2 (g) =CO2(g)+ 2S(s)+ 2 H2O(1) △H =_____kJ/mol
(2)在恒容密闭容器中,用 H2还原SO2生成S 的反应分两步完成(如图1所示),该过程中相关物质的物质的量浓度随时间的变化关系如图2所示 :

分析可知X为_______(填化学式),o~t1时间段的温度为_______,o~ t1时间段用SO2表示的化学反应速率为______________。
(3)焦炭催化还原SO2生成S2, 化学方程式为2C(s)+ 2 SO2 (g)![]() S2(g)+2CO2(g)△H < 0。
S2(g)+2CO2(g)△H < 0。
实验测得:v正= k 正c2 (SO2 ) , v逆= k 逆c(S2 ) c2 ( CO 2) ( k正、k逆为速率常数,只与温度有关).某温度下,向2L的恒容密闭容器中充入lmol SO2,并加入足量焦炭,当反应达平衡时,SO2 转化率为80%,则:
①k正:k 逆=_______________。
②若升高温度,k正增大的倍数______( 填“> ”、“< ”或“= ”) k 逆增大的倍数。
(4) 利用如图所示装置(电极均为惰性电极)可吸收SO2。

直流电源a为_______极,电解时.电极B的电极反应式为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取9.28g Na2CO3·x H2O溶于水配成5mL溶液,然后逐滴滴入稀盐酸直至没有气体放出为止,用去盐酸20mL,并收集到896mL CO2(标准状况下)。求:
(1)稀盐酸的物质的量浓度;________
(2)x的值。_________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钾和碘的相关化合物在化工、医药、材料等领域有着广泛的应用。回答下列问题:
(1)准晶是一种无平移周期序,但有严格准周期位置序的独特晶体,可通过________方法区分晶体、准晶体和非晶体。
(2)基态K原子中,核外电子排布图是_________,占据最高能层电子的电子云轮廓图形状为___________。K和Cr属于同一周期,且核外最外层电子构型相同,但金属K的熔点、沸点等都比金属Cr低,原因是______________________________________。
(3)测定发现I3AsF6中存在I3+离子。I3+离子的几何构型为_____________,中心原子的杂化类型为________________。
(4)KIO3晶体是一种性能良好的非线性光学材料,具有钙钛矿型的立体结构,边长为a=0.446nm,晶胞中K、I、O分别处于顶角、体心、面心位置,如图所示。K与O间的最短距离为______nm,与K紧邻的O个数为__________。

(5)在KIO3晶胞结构的另一种表示中,I处于各顶角位置,则K处于______位置,O处于______位置。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铅蓄电池是典型的可充电电池,电池总反应式为:Pb+PbO2+2H2SO4 ![]() 2PbSO4+2H2O。回答下列问题:
2PbSO4+2H2O。回答下列问题:
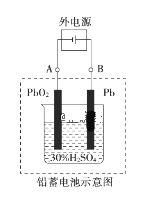
(1)放电时,负极为_______电极,试写出该电极的电极反应式是___________。电解液中H2SO4的浓度将变____________。(填“升高”、 “降低” 或“不变”)
(2)电池放电时,当外电路通过0.1 mol电子时,理论上负极板的质量增加________g,电池中消耗的硫酸物质的量为_______mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳、氮能形成多种氧化物、氢化物。
(1)已知:①2NO(g)![]() N2(g)+O2(g) △H1=-180.5 kJ·mol-1
N2(g)+O2(g) △H1=-180.5 kJ·mol-1
②CO(g)+![]() O2(g)
O2(g)![]() CO2(g) △H2=-283 kJ·mol-1
CO2(g) △H2=-283 kJ·mol-1
则NO与CO反应生成两种无毒气体的热化学方程式为________________。
(2)使用高效催化剂可大大减少汽车尾气排放出的NOx含量,某研究所的科研人员探究了T1℃时等质量的三种催化剂对CO还原NO的催化效果(其他条件相同),所得结果如图1所示。

①如果不考虑催化剂价格,则使用催化剂____(填“Ⅰ”“Ⅱ”或“Ⅲ”)最好;A、B两状态下,生成CO的速率大小关系是_____。
②若容器容积为2 L,开始时加入0.5 mol NO、0.5 mol CO,在催化剂Ⅰ的作用下达到如图1所示平衡,则反应2NO(g)+2CO(g)![]() N2(g)+2CO2(g)在该温度下的平衡常数K=____L·mol-1。
N2(g)+2CO2(g)在该温度下的平衡常数K=____L·mol-1。
③在图2坐标系中画出使用催化剂Ⅰ(其他条件相同)时,25s时容器内反应的脱氮率(NO转化率)与温度的关系图____。
(3)化学动力学上将一步完成的反应称为基元反应。对于基元反应:aA+bB![]() cC+dD,其速率方程式为v=k·ca(A)·cb(B)(k为只与温度有关的速率常数),复杂反应(由几个基元反应构成)的速率取决于慢的基元反应。
cC+dD,其速率方程式为v=k·ca(A)·cb(B)(k为只与温度有关的速率常数),复杂反应(由几个基元反应构成)的速率取决于慢的基元反应。
①已知反应NO2(g)+CO(g)![]() NO(g)+CO2(g)△H<0,在温度低于250℃时是由两个基元反应构成的复杂反应,该反应的速率方程式为v=k·c2(NO2),则其两个基元反应分别为:Ⅰ.____=NO3+_____;Ⅱ.略,这两个反应中活化能较小的是___。
NO(g)+CO2(g)△H<0,在温度低于250℃时是由两个基元反应构成的复杂反应,该反应的速率方程式为v=k·c2(NO2),则其两个基元反应分别为:Ⅰ.____=NO3+_____;Ⅱ.略,这两个反应中活化能较小的是___。
②某科研小组测得380℃时该反应的c(NO2)、c(CO)与生成CO2的速率[v(CO2)]的关系如下:

则该温度下的反应速率常数k=____L·mol-1·s-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组欲利用CuO与NH3反应,研究NH3的某种性质并测定其组成,设计了如下实验装置(夹持装置未画出)进行实验。请回答下列问题:

(1)仪器a的名称为____,仪器b中可选择的试剂为____。
(2)实验室中,利用装置A,还可制取的无色气体是____(填字母)。
A.Cl2 | B.O2 | C.CO2 | D.NO2 |
(3)实验中观察到装置C中黑色CuO粉末变为红色固体,量气管有无色无味的气体产生,上述现象证明NH3具有____性,写出相应的化学方程式:_______________________。
(4)E装置中浓硫酸的作用是_____________________________________。
(5)读取气体体积前,应对装置F进行的操作:____________________________。
(6)实验完毕,若测得干燥管D增重m g,装置F测得气体的体积为n L(已折算成标准状况),则氨分子中氮、氢的原子个数比为____(用含m、n字母的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纳米TiO2在涂料、光催化、化妆品等领域有着极其广泛的应用。制备纳米TiO2的方法之一是TiCl4水解生成TiO2xH2O,经过滤、水洗除去其中的Cl-,再烘干、焙烧除去水分得到粉体TiO2。用氧化还原滴定法测定TiO2的质量分数:一定条件下,将TiO2溶解并还原为Ti3+,再以KSCN溶液作指示剂,用NH4Fe(SO4)2标准溶液滴定Ti3+至全部生成Ti4+。请回答下列问题:
(1)如图分别是温度计、量筒、滴定管的一部分,其中A仪器的名称为________,B的正确读数为________。

(2)TiCl4水解生成TiO2xH2O的化学方程式为______________________________。
(3)判断滴定终点的现象是________________________________________。
(4)滴定分析时,称取TiO2(摩尔质量为M g/mol)试样wg,消耗c mol/L NH4Fe(SO4)2 标准溶液VmL,则TiO2质量分数表达式为______________________________。
(5)判断下列操作对TiO2质量分数测定结果的影响(填“偏高”、“偏低”或“无影响”)。
①若在配制标准溶液过程中,烧杯中的NH4Fe(SO4)2溶液有少量溅出,使测定结果________。
②若在滴定终点读取滴定管读数时,俯视标准液液面,使测定结果__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前,处理烟气中 SO2 常采用两种方法:碱液吸收法和水煤气还原法。
Ⅰ.碱液吸收法
25℃时,Kb(NH3·H2O)=1.8×10-5;H2SO3:Ka1=1.5×10-2,Ka2=1.0×10-7;Ksp(CaSO4)=7.1×10-5。
第1步:用过量的浓氨水吸收 SO2,并在空气中氧化;
第2步:加入石灰水,发生反应 Ca2++2OH-+2NH4++SO42-CaSO4↓+2NH3·H2O K。
(1)25℃时,0.1 mol·L-1(NH4)2SO3 溶液的 pH_____(填“>”“<”或“=”)7。
(2)计算第2步中反应的 K=_____。
Ⅱ.水煤气还原法
已知:①2CO(g)+SO2(g)=S(l)+2CO2(g) ΔH1=-37.0 kJ·mol-1
②2H2(g)+SO2(g)=S(l)+2H2O(g) ΔH2=+45.4 kJ·mol-1
③CO 的燃烧热ΔH3=-283 kJ·mol-1
(3)表示液态硫(S)的燃烧热的热化学方程式为_________。
(4)反应②中,正反应活化能 E1_____(填“>”“<”或“=”)ΔH2。
(5)在一定压强下,发生反应①。平衡时SO2的转化率α(SO2)与投料比的比值[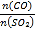 =y]、温度 T 的关系如图所示。
=y]、温度 T 的关系如图所示。
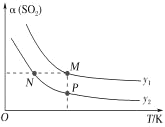
比较平衡时CO的转化率α(CO):N_____M。逆反应速率:N_____P(填“>”“<”或“=”)。
(6)某温度下,向10L恒容密闭容器中充入2molH2、2 molCO和2molSO2发生反应①、②,第5min时达到平衡,测得混合气体中CO2、H2O(g)的物质的量分别为1.6 mol、1.8 mol。
①该温度下,反应②的平衡常数K为_____。
②其他条件不变,在第 7 min 时缩小容器体积,SO2的平衡浓度_____(填“增大”“减小”或“不变”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com