
标准状况下,将a L H2和Cl2的混合气体点燃,充分反应后,将混合气体通入含b mol NaOH的热溶液中,气体恰好被完全吸收,NaOH无剩余,测得反应后溶液中含Cl-、ClO-、ClO,且三者物质的量之比为8∶1∶1,则原混合气体中H2的物质的量为( )
A.a/2 mol
B.(a/22.4-b)mol
C.(a/22.4-b/2)mol
D.b/2 mol
 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案科目:高中化学 来源:2015-2016学年河北省高二上二调考试化学试卷(解析版) 题型:填空题
氨气是一种重要工业原料,在工农业生产中具有重要的应用.
(1)已知:N2(g)+O2(g)═2NO(g);△H=+180.5kJ•mol-1
4NH3(g)+5O2(g)═4NO(g)+6H2O(g);△H=-905kJ•mol-1
2H2(g)+O2(g)═2H2O(g);△H=-483.6kJ•mol-1
则N2(g)+3H2(g)═2NH3(g);△H=______
(2)工业合成氨气的反应为N2(g)+3H2(g) 2NH3(g);在一定温度下,将一定量的N2和H2通入到初始体积为1L的密闭容器中达到平衡后,单独改变下列条件,能使平衡向正反应方向移动且平衡常数不变的是______.(填序号)
2NH3(g);在一定温度下,将一定量的N2和H2通入到初始体积为1L的密闭容器中达到平衡后,单独改变下列条件,能使平衡向正反应方向移动且平衡常数不变的是______.(填序号)
①增大压强 ②增大反应物的浓度 ③使用催化剂 ④降低温度
(3)将相同体积、pH之和为14的氨水和盐酸混合后,溶液中离子浓度由大到小的顺序为______.
(4)氢气是合成氨的原料之一,下图是以SO2、I2、H2O为原料,利用核能使水分解制氢气的一种流程。

反应X的化学方程式为SO2+I2+2H2O=2HI+H2SO4该流程中循环使用的原料除了SO2外,还有 。从理论上讲,该流程中,1mol原料水制得 molH2。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年重庆市高二上期中测试化学试卷(解析版) 题型:选择题
25℃时,水的电离达到平衡:H2O H++OH- △H>0,下列叙述正确的是( )
H++OH- △H>0,下列叙述正确的是( )
A.向水中加入少量固体硫酸氢钠,c(H+)增大,Kw不变
B.向水中加入氨水,平衡逆向移动,c(OH-)降低
C.向水中加入固体硫酸铜,平衡逆向移动,c(OH-)减小
D.将水加热,KW增大,pH不变
查看答案和解析>>
科目:高中化学 来源:2016届安徽省高三上学期12月月考化学试卷(解析版) 题型:选择题
下列表示对应化学反应的离子方程式正确的是( )
A.用食醋检验牙膏中的摩擦剂碳酸钙:CaCO+2H+===Ca2++H2O+CO2↑
B.明矾溶于水产生Al(OH) 3胶体:Al3++3H2O===Al(OH)3↓+3H+
C.向次氯酸钠溶液中通入少量SO2:ClO-+SO2+H2O===Cl-+SO42-+2H+
D.Ca(HCO3) 2溶液与少量NaOH溶液反应:HCO3-+Ca2++OH-===CaCO3↓+H2O
查看答案和解析>>
科目:高中化学 来源:2016届安徽省高三上第四次段考化学试卷(解析版) 题型:选择题
在1L溶液中含有Fe(NO3)3和H2SO4两种溶质,其浓度分别为0.2mol·L-1和1.5 mol·L-1,
现向该溶液中加入39.2 g铁粉使其充分反应。下列有关说法正确的是
A.反应后溶液中Fe3+物质的量为0.8 mol
B.反应后产生13.44 L H2(标准状况)
C.由于氧化性Fe3+>H+,故反应中先没有气体产生后产生气体
D.反应后溶液中Fe2+和Fe3+物质的量之和为0.9 mol
查看答案和解析>>
科目:高中化学 来源:2016届吉林长春外国语学校高三上第一次质检化学试卷(解析版) 题型:选择题
下列图示与对应的叙述相符的是
A.由图甲可以判断:若T1>T2,反应A(g)+ B(g) 2C(g)的△H<0
2C(g)的△H<0
B.图乙表示压强对可逆反应2A(g)+2 B(g) 3C(g)+D(s)的影响,乙的压强比甲的压强大
3C(g)+D(s)的影响,乙的压强比甲的压强大
C.根据图丙,若除去CuSO4溶液中的Fe3+,可向溶液中加入适量NaOH溶液,调节pH≈4
D.图丁表示用0.1mol/L的盐酸滴定20mL 0.1mol/LNaOH溶液,溶液pH随加入盐酸体积的变化

查看答案和解析>>
科目:高中化学 来源:2016届福建省高三上学期期中考试化学试卷(解析版) 题型:选择题
下列有关热化学方程式的叙述正确的是
A.2H2(g)+O2(g)=2H2O(g) △H=-483.6kJ•mol-1,则氢气的燃烧热为241.8kJ•mol-1
B.已知C(石墨,s)=C(金刚石,s) △H>0,则金刚石比石墨稳定
C.含20.0gNaOH的稀溶液与稀盐酸完全中和,放出28.7kJ的热量,则该反应中和热的热化学方程式为:NaOH+HCl=NaCl+H2O △H=-57.4kJ•mol-1
D.已知2C(s)+2O2(g)=2CO2(g) △H1,2C(s)+O2g)=2CO(g) △H2 则△H1<△H2
查看答案和解析>>
科目:高中化学 来源:2016届安徽省高三上学期12月第四次月考化学试卷(解析版) 题型:填空题
将磷肥生产中形成的副产物石膏(CaSO4·2H2O)转化为硫酸钾肥料和氯化钙水合物储热材料,无论从经济效益、资源综合利用还是从环境保护角度看都具有重要意义。以下是石膏转化为硫酸钾和氯化钙的工艺流程示意图。
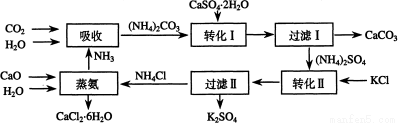
(1)本工艺中所用的原料除CaSO4·2H2O、KCl外,还需要 等原料
(2)写出石膏悬浊液中加入碳酸铵溶液后发生反应的离子方程式:
(3)过滤Ⅰ操作所得固体中,除CaCO3外还含有 (填化学式)等物质,该固体可用作生产水泥的原料。
(4)过滤Ⅰ操作所得滤液是(NH4)2SO4溶液。检验滤液中含有CO32-的方法是:
__________ 。
(5)已知不同温度下K2SO4在100g水中达到饱和时溶解的量如下表:
温度(℃) | 0 | 20 | 60 |
K2SO4溶解的量(g) | 7.4 | 11.1 | 18.2 |
60℃时K2SO4的饱和溶液591g冷却到0℃,可析出K2SO4晶体 g
(6)氯化钙结晶水合物(CaCl2·6H2O)是目前常用的无机储热材料,选择的依据是
A、熔点较低(29℃熔化) b、能导电 c、能制冷 d、无毒
(7)上述工艺流程中体现绿色化学理念的是:
查看答案和解析>>
科目:高中化学 来源:2016届黑龙江省高三上学期12月月考化学试卷(解析版) 题型:选择题
在相同温度下等体积、等物质的量浓度的4种稀溶液:①Na2SO4 ②H2SO3 ③NaHSO3 ④Na2S,所含带电微粒的数目由多到少的顺序是 ( )
A.①=④>③=② B.①=④>③>② C.①>④>③>② D.④>①>③>②
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com