
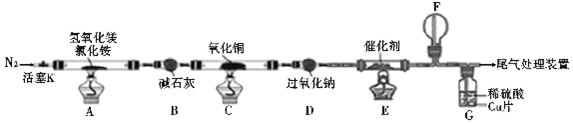
分析 A中反应得到MgOHCl,还生成NH3与H2O,碱石灰干燥氨气,C中氨气与氧化铜反应会得到氮气与水,D中过氧化钠水反应生成氧气,E中氨气与氧气发生催化氧化,F中NO与氧气反应得到二氧化氮,G中二氧化氮溶解得到硝酸,硝酸与Cu反应.
(1)氢氧化镁与氯化铵再加热条件下反应生成MgOHCl、NH3与H2O,据此书写方程式;
(2)D中过氧化钠水反应生成氧气,为E中氨气与氧气反应提供氧气;
(3)二氧化氮为红棕色气体,F中NO与氧气反应生成二氧化氮;
(4)固体质量减少质量为减少的氧元素质量,再计算CuO中氧元素质量,可以判断红色固体的组成,红色物质为Cu或Cu2O或二者混合物,根据原子守恒和得失电子守恒书写方程式,根据Cu元素守恒、红色固体总质量计算组成物质的量,进而计算转移电子;
(5)G中二氧化氮溶解得到硝酸,硝酸与Cu反应,稀硫酸有剩余,根据原子守恒可知反应后装置G中还含有的主要溶质是硫酸铜;
(6)①说明 NO2-有氧化性,则N元素的化合价降低,在酸性条件下,与还原剂KI反应即可;
②说明 NO2-有还原性,则N元素的化合价升高,与氧化剂KMnO4反应即可.
解答 解:(1)氢氧化镁与氯化铵再加热条件下反应生成MgOHCl、NH3与H2O,反应方程式为:Mg(OH)2+NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$MgOHCl+NH3↑+H2O,
故答案为:Mg(OH)2+NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$MgOHCl+NH3↑+H2O;
(2)E中氨气与氧气发生催化氧化,需反应物氧气,D中过氧化钠水反应2Na2O2+2H2O=4NaOH+O2↑,生成氧气,为探究氨的催化氧化提供O2,
故答案为:与水反应为探究氨的催化氧化提供O2;
(3)F中NO与氧气反应生成红棕色的二氧化氮气体,所以一段时间后,装置 F中观察到的现象为生成红棕色气体,
故答案为:生成红棕色气体;
(4)固体质量减少质量为减少的氧元素质量,则减少的氧元素质量为8g-6.8g=1.2g,而CuO中氧元素质量为8.0g×$\frac{16}{80}$=1.6g>1.2g,故红色固体为Cu、Cu2O混合物,生成的气体可直接排放到大气中,为氮气,所以反应方程式为:4CuO+2NH3$\frac{\underline{\;\;△\;\;}}{\;}$2Cu+Cu2O+N2+3H2O,设Cu、Cu2O二者物质的量分别为xmol、ymol,则:x+2y=$\frac{8}{80}$(铜元素守恒),64x+144y=6.8(质量守恒)解得x=0.05mol,y=0.025mol,则转移电子为0.05mol×2+0.025mol×2=0.15mol,
故答案为:4CuO+2NH3$\frac{\underline{\;\;△\;\;}}{\;}$2Cu+Cu2O+N2+3H2O;0.15;
(5)铜在硫酸中不溶解,但在硝酸中溶解,G中二氧化氮溶解得到硝酸,硝酸与Cu反应,因稀硫酸有剩余,根据原子守恒可知反应后装置G中还含有的主要溶质是硫酸铜,
故答案为:硫酸铜;
(6)①碘单质与淀粉作用显示蓝色,说明 NO2-有氧化性,则N元素的化合价降低,在酸性条件下,与还原剂KI反应,所以选择的试剂为KI-淀粉溶液、稀硫酸,观察到现象溶液变蓝,证明其具有氧化性,故答案为:KI-淀粉溶液;
②说明 NO2-有还原性,则N元素的化合价升高,与氧化剂KMnO4反应,验证方法为:取适量NaNO2溶液,滴加少许酸性KMnO4溶液,观察到溶液褪色,证明其具有还原性,故答案为:取适量NaNO2溶液,滴入几滴酸性KMnO4溶液,观察到溶液褪色,证明其具有还原性.
点评 本题考查物质的制备及性质探究实验,关键是理解各装置作用,熟练掌握元素化合物性质,(4)中注意利用氧元素质量变化判断固体组成,也可以利用Cu元素质量确定,(6)中充分利用题目信息进行实验设计,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| 选项 | 规律 | 结论 |
| A | 同主族元素性质的相似性 | 钠和氧反应可以形成Na2O2,也可以和硫形成Na2S2 |
| B | 反应物浓度越大,反应速率越快 | 常温下,相同的铁片分别加入足量的稀硫酸和浓硫酸中,浓硫酸中铁片先溶解完 |
| C | 结构和组成相似的物质,沸点随相对分子质量增大而升高 | H2O沸点低于H2S |
| D | 较强酸可以制取较弱酸 | 亚硫酸和次氯酸钙反应可以制取次氯酸 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 136.8kJ | B. | 110.9kJ | C. | 83.2kJ | D. | 82.4kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
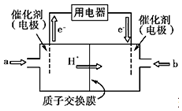 氢氧燃料电池的结构示意图如图所示,一极通入氢气,另外一极通入氧气;电解质溶液是稀硫酸.(图中:质子交换膜只允许H+通过)
氢氧燃料电池的结构示意图如图所示,一极通入氢气,另外一极通入氧气;电解质溶液是稀硫酸.(图中:质子交换膜只允许H+通过)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶解时有少量液体溅出 | B. | 洗涤液未全部转移到容量瓶中 | ||
| C. | 容量瓶使用前未干燥 | D. | 定容时液面未到刻度线 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 是氢元素的五种核素 | |
| B. | ${\;}_{1}^{1}$H2、${\;}_{1}^{2}$H2互称为同素异形体 | |
| C. | ${\;}_{1}^{1}$H、${\;}_{1}^{2}$H、${\;}_{1}^{3}$H互称为同位素 | |
| D. | ${\;}_{1}^{1}$H、${\;}_{1}^{2}$H、${\;}_{1}^{3}$H的化学性质不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| X | Y | |
| Z | W |
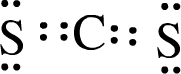 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
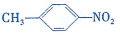 和
和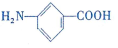
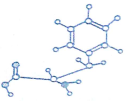
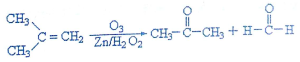

查看答案和解析>>
科目:高中化学 来源: 题型:推断题
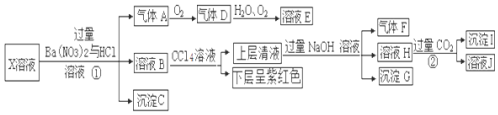
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com