
用NA表示阿伏加德罗常数的值。下列叙述正确的是( )
A. 1molCl2与Fe粉完全反应时转移电子数为2NA
B. 过氧化钠与水反应时,每生成1molO2,转移4mol电子
C. 标准状况下,11.2L氟化氢中含有氟原子的数目为0.5NA
D. 0.1 mol·L-1NaHSO4溶液中,阳离子数目之和为0.3NA
科目:高中化学 来源:2017届陕西省高三上学期第二次模考化学试卷(解析版) 题型:填空题
实验室可由软锰矿(主要成分为MnO2)制备KMnO4,方法如下:软锰矿与过量固体KOH和KClO3在高温下反应,生成锰酸钾(K2MnO4)和KCl;用水溶解,滤去残渣,滤液酸化后,K2MnO4转变为MnO2和KMnO4;滤去MnO2沉淀,浓缩滤液,结晶得到深紫色的针状KMnO4。请回答:
(1)软锰矿制备K2MnO4的化学方程式是_______________________;
(2)K2MnO4制备KMnO4的离子方程式是_______________;
(3)若用2.5g软锰矿(含MnO2 80%)进行上述实验,KMnO4的理论产量为_______________。
(4)KMnO4能与热的经硫酸酸化的Na2C2O4溶液反应生成Mn2+和CO2,该反应的化学方程式是________________________;
(5)上述制得KMnO4产品0.165g,恰好与0.335g Na2C2O4反应完全,该KMnO4的纯度为___。
查看答案和解析>>
科目:高中化学 来源:2017届浙江省高三3月选考化学试卷(解析版) 题型:选择题
下列关于能源的说法不正确的是
A. 植物通过光合作用,将太阳能转化为生物质能
B. 在农村推广建造沼气池,是对生物质能的有效利用
C. 天然气的主要成分是甲烷,是一种可再生的清洁能源
D. 氢能是重要的清洁能源,在蓝绿藻、微生物和太阳光作用下使水分解制氢是目前科学家研究的新方法之一
查看答案和解析>>
科目:高中化学 来源:2016-2017学年黑龙江省高一下学期开学考试化学试卷(解析版) 题型:选择题
镁铝合金4.08 g溶于250 ml 2mol/L的盐酸中,标准状况下放出气体的体积为4.48 L,向反应后的溶液中加入500 ml NaOH溶液,充分反应后最终产生白色沉淀。下列有关说法不正确的是( )
A. 4.08 g镁铝合金中含有镁和铝的质量分别为1.92g、2.16g
B. 生成沉淀的最大质量为10.88 g
C. 若白色沉淀只有Mg(OH)2,该NaOH溶液的浓度至少为0.96mol/L
D. 溶解4.08 g镁铝合金时,剩余盐酸的物质的量为0.1 mol
查看答案和解析>>
科目:高中化学 来源:2016-2017学年黑龙江省高一下学期开学考试化学试卷(解析版) 题型:选择题
下列关于合金的叙述中正确的是( )
A. 日常生活中用到的五角硬币属于铜合金
B. 低碳钢比中碳钢强度高
C. 合金在任何情况都比单一金属性能优良
D. 合金是由两种或多种金属熔合而成的
查看答案和解析>>
科目:高中化学 来源:2016-2017学年新疆哈密地区第二中学高二上学期期末考试化学试卷(解析版) 题型:填空题
已知25℃、101kPa时,一些物质的燃烧热为:
化学式 | CO(g) | H2(g) | CH3OH(l) | CH4(g) |
ΔH/(kJ/mol) | -283.0 | -285.8 | -726.51 | -890. 31 |
请回答下列问题:
(1)根据盖斯定律完成下列反应的热化学方程式:
CO(g)+2H2(g)==CH3OH(l) ΔH=_________。
(2)现有H2和CH4的混合气体112 L(标准状况),使其完全燃烧生成CO2(g)和H2O(l),共放出热量3 242.5 kJ,则原混合气体中H2和CH4的物质的量之比是:____________。
A.1:1 B.1:3 C.1:4 D.2:3
查看答案和解析>>
科目:高中化学 来源:2016-2017学年新疆哈密地区第二中学高二上学期期末考试化学试卷(解析版) 题型:选择题
对于反应2NO2(g) N2O4(g) ΔH<0,达到平衡后缩小容器体积,下列说法正确的是
N2O4(g) ΔH<0,达到平衡后缩小容器体积,下列说法正确的是
A. 平衡逆向移动 B. 混合气体颜色比原来深
C. 混合气体颜色比原来浅 D. 混合气体的平均相对分子质量变小
查看答案和解析>>
科目:高中化学 来源:2016-2017学年新疆哈密地区第二中学高二上学期期末考试化学试卷(解析版) 题型:选择题
一定量的盐酸跟过量锌粉反应时,为了减缓反应速率但又不影响生成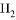 的总量,可采取的措施是( )
的总量,可采取的措施是( )
A. 加入少量 固体 B. 加入少量
固体 B. 加入少量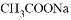 固体
固体
C. 加入少量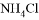 固体 D. 加入少量
固体 D. 加入少量 固体
固体
查看答案和解析>>
科目:高中化学 来源:2017届贵州省贵阳市高三2月适应性考试(一)理综化学试卷(解析版) 题型:实验题
纳米ZnO的颗粒直径介于1~100nm之间,具有许多特殊的性能,可用于制造变阻器、图像记录材料、磁性材料和塑料薄膜等。一种利用粗ZnO(含FeO、Fe2O3、CuO)制备纳米ZnO的生产工艺流程如下图所示:
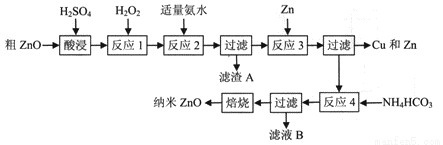
已知:① 生成氢氧化物沉淀时溶液的pH如下表:
物质 | Fe(OH)2 | Fe(OH)3 | Zn(OH)2 | Cu(OH)2 |
开始沉淀时pH | 6.34 | 1.48 | 6.2 | 5.2 |
完全沉淀时pH | 9.7 | 3.2 | 8.0 | 6.4 |
② 25℃时,Fe(OH)3的溶度积常数Ksp=4.0×10-38。
请回答以以下问题:
(1)酸浸时,为了提高浸出率,可采取的措施有________(填写两种);
(2)反应1中发生反应的离子方程式为______________,一种双氧水的质量分数为34.0 % (密度为1.13g/cm3) ,其浓度为_______mol/L;
(3)反应2中加适量氨水的目的是_________,此时所需pH的范围为_________,当调节溶液pH=5时,溶液中的c(Fe3+)=__________;
(4)反应3的离子方程式为__________,反应类型为__________;
(5)从滤液B中可回收的主要物质是__________;
(6)经检验分析,反应4 所得固体组成为Zna(OH)bCO3,称取该固体22.4g,焙烧后得固体16.2g,则a=_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com