
| ���� | X | Y | Z |
| ��ʼŨ��/mol•L-1 | 0.1 | 0.2 | 0 |
| ƽ��Ũ��/mol•L-1 | 0.05 | 0.05 | 0.1 |
| A�� | ��Ӧ�ﵽƽ��ʱ��X��ת����Ϊ50% | |
| B�� | ��Ӧ�ɱ�ʾΪX+3Y?2Z��ƽ�ⳣ��Ϊ1600 | |
| C�� | ������������ʱ������ѹǿ��ʹƽ�ⳣ������ | |
| D�� | �ı��¶ȿ��Ըı�÷�Ӧ��ƽ�ⳣ�� |
���� X��Y��Ũ�ȼ�С��Ϊ��Ӧ�Z��Ũ������Ϊ�����Ũ�ȱ仯��֮�ȣ�0.1-0.05������0.2-0.05������0.1-0��=1��3��2����ӦΪX+3Y?2Z��
A��ת����=$\frac{ת������}{��ʼ����}$��100%��
B��KΪ������Ũ����֮���뷴Ӧ��Ũ����֮���ıȣ����ƽ��Ũ�ȼ���K��
C��Kֻ���¶��йأ�
D��Kֻ���¶��йأ��ı��¶ȣ�Kһ���仯��
��� �⣺X��Y��Ũ�ȼ�С��Ϊ��Ӧ�Z��Ũ������Ϊ�����Ũ�ȱ仯��֮�ȣ�0.1-0.05������0.2-0.05������0.1-0��=1��3��2����ӦΪX+3Y?2Z��
A����Ӧ�ﵽƽ��ʱ��X��ת����Ϊ$\frac{0.1-0.05}{0.1}$��100%=50%����A��ȷ��
B��X+3Y?2Z��K=$\frac{0��{1}^{2}}{0.05����0.05��^{3}}$=1600����B��ȷ��
C��Kֻ���¶��йأ�������ѹǿʱƽ�ⳣ�����䣬��C����
D��Kֻ���¶��йأ��ı��¶ȿ��Ըı�÷�Ӧ��ƽ�ⳣ������D��ȷ��
��ѡC��
���� ���⿼�黯ѧƽ��ļ��㣬Ϊ��Ƶ���㣬����Ũ�ȱ仯����Ӧ��ȷ����K�ļ��㡢K���¶ȵĹ�ϵΪ���Ĺؼ������ط�����Ӧ�������Ŀ��飬ע������ƽ��Ũ�ȼ���K����Ŀ�ѶȲ���



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 15mol 20% | B�� | 20mol 20% | C�� | 20mol 80% | D�� | 40mol 80% |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����

| A�� | ��ͼAװ����ȡ����CO2���� | |
| B�� | �����NH3����ͼBװ������ | |
| C�� | װ��C�ɷ���е㲻ͬ�һ��ܵ�Һ������ | |
| D�� | ͼD�ɼ��װ�õ������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �ȶ��� | B�� | ���� | ||
| C�� | �ܷ������������ | D�� | ��ɢ������С |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��������Cu2OΪ1.44 g | |
| B�� | ��������������Ϊ0.14 mol | |
| C�� | ������0.5 moI/L����140 mL��Cu2O��Ӧ | |
| D�� | ת�Ƶĵ�������Ϊ0.06 NA |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 1molC������12 g•mol-1 | |
| B�� | 22.4L H2�����ʵ�����1mol | |
| C�� | ��60gNaOH����1Lˮ�У�������Һ��NaOH�����ʵ���Ũ����1.5mol•L-1 | |
| D�� | NaCl��Ħ��������58.5 g•mol-1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��Һ��Cu2+Ũ������ | B�� | ��Һ��Cu2+��Ŀ���� | ||
| C�� | ����Һ��pH��С | D�� | ��Һ����ɫ��dz |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
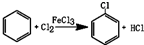
| ��Ŀ | ���ȱ� | β�� | ��ȷ������ | ��ʧ���� |
| ����ʧ����kg/t�� | 13 | 24.9 | 51.3 | 89.2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com