
| A. | 2Na+2H2O═2NaOH+H2↑ | B. | SO2+2H2S═3S↓+2H2O | ||
| C. | Mg3N2+6H2O═3Mg(OH)2↓+2NH3↑ | D. | AgNO3+NaCl═AgCl↓+NaNO3 |
分析 一般来说,活泼金属和活泼非金属元素之间易形成离子键,非金属元素之间易形成共价键,化学反应中有化学键的断裂和形成,据此分析解答.
解答 解:A.2Na+2H2O=2NaOH+H2↑中有共价键的断裂、离子键的形成、共价键的形成,没有离子键的断裂,故A错误;
B.SO2+2H2S=3S+2H2O中有共价键的断裂和形成,没有离子键的断裂和形成,故B错误;
C.Mg3N2+6H2O=3Mg(OH)2↓+2NH3↑中有离子键的断裂和形成、共价键的断裂和形成,故C正确;
D.AgNO3+NaCl═AgCl↓+NaNO3中有离子键的断裂和形成,没有共价键的断裂和形成,故D错误;
故选C.
点评 本题考查了化学键和化学反应,明确化学键的断裂位置是解本题关键,注意特殊物质化学键的断裂方式,题目难度中等.


 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
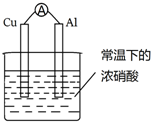
| A. | Cu是原电池的负极 | |
| B. | 电流由Cu电极流出 | |
| C. | 电子由Al沿导线流向Cu | |
| D. | 铝片上的电极反应式为:Al-3e-═Al3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 质子数:c>b | B. | 离子半径:X+>Z- | C. | 稳定性:H2Y>HZ | D. | 碱性:XOH>W(OH)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用氯化铝和纯硝酸反应 | |
| B. | 氯化铝与氢氧化钠反应,过滤得沉淀,再加稀HNO3 | |
| C. | 用AlCl3溶液和氨水反应,过滤得沉淀,再加稀HNO3 | |
| D. | AlCl3溶液和Ba(NO3)2溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③④⑦ | B. | ②④⑥⑧ | C. | ③⑤⑦⑧ | D. | ③④⑥⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 至少存在5种离子 | |
| B. | CO32-、Al3+一定不存在,K+可能存在 | |
| C. | SO42-、NH4+一定存在,Cl-可能不存在 | |
| D. | Cl-一定存在 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X | Y | |||
| W |
| A. | 五种元素中,原子半径最大的是W | |
| B. | Y 的氧化性比W的氧化性强 | |
| C. | Y与Z形成的化合物都可以和水反应 | |
| D. | Z与Q形成的化合物一定是离子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NF3 | B. | C${H}_{3}^{-}$ | C. | SO3 | D. | H3O+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com