
| A£® | ŌŚ¢ŚµÄČÜŅŗÖŠŅ»¶ØÓŠ£ŗc£ØNa+£©£¾c£ØHA-£©£¾c£ØOH-£©£¾c£ØH+£© | |
| B£® | ĖÄÖÖČÜŅŗÖŠĄė×Ó×ÜŹżµÄ¹ŲĻµ£ŗ¢Ü£¾¢Ū£¾¢Ś£¾¢Ł | |
| C£® | ĖÄÖÖČÜŅŗÖŠc£ØH+£©µÄ¹ŲĻµ£ŗ¢Ł£¾¢Ś£¾¢Ū£¾¢Ü | |
| D£® | ŌŚ¢ŁµÄČÜŅŗÖŠ£ŗc£ØH+£©=c£ØHA-£©+c£ØA2-£©+c£ØOH-£© |
·ÖĪö ÓÉÓŚH2AµÄµŚŅ»²½µēĄėĶźČ«½ųŠŠ”¢µŚ¶ž²½“ęŌŚµēĄėĘ½ŗā£¬ŌņHA-Ąė×ÓŌŚČÜŅŗÖŠ²æ·ÖµēĄė£¬ČÜŅŗ³ŹĖįŠŌ£¬
A£®ČÜŅŗÖŠHA-²æ·ÖµēĄė£¬ČÜŅŗĻŌŹ¾ĖįŠŌ£¬Ōņc£ØNa+£©£¾c£ØHA-£©”¢c£ØOH-£©£¾c£ØH+£©£»
B£®øł¾ŻµēĄėĘ½ŗāµÄÓ°ĻģŅņĖŲ¼°ŃĪµÄĖ®½āŌĄķ½ųŠŠ·ÖĪö£»
C£®ĒāĄė×ÓÅضČ×ī“óµÄĪŖ¢Ł£¬¢ŚÖŠĒāĄė×ÓÅØ¶Č½öŠ”ÓŚ¢Ł£¬×īŠ”µÄĪŖ¢Ü£¬¾Ż“Ė½ųŠŠ·ÖĪö£»
D£®øł¾Ż¢ŁČÜŅŗÖŠµÄµēŗÉŹŲŗć·ÖĪö£®
½ā“š ½ā£ŗH2AµÄµŚŅ»²½µēĄėĶźČ«½ųŠŠ”¢µŚ¶ž²½“ęŌŚµēĄėĘ½ŗā£¬ŌņHA-Ąė×ÓŌŚČÜŅŗÖŠ²æ·ÖµēĄė£¬ČÜŅŗ³ŹĖįŠŌ£¬
A.0.02mol•L-1µÄNaHAČÜŅŗÖŠ£¬HA-²æ·ÖµēĄė£¬ČÜŅŗĻŌŹ¾ĖįŠŌ£¬Ōņc£ØNa+£©£¾c£ØHA-£©”¢c£ØOH-£©£¾c£ØH+£©£¬ČÜŅŗÖŠĄė×ÓÅØ¶Č“óŠ”ĪŖ£ŗc£ØNa+£©£¾c£ØHA-£©£¾c£ØOH-£©£¾c£ØH+£©£¬¹ŹAÕżČ·£»
B£®¢Ł0.02mol•L-1µÄH2AČÜŅŗÖŠ£¬H2AµŚŅ»²½ĶźČ«µēĄė£¬µēĄė³öµÄĒāĄė×ÓĪŖ0.02mol/L£¬c£ØHA-£©ĪŖ0.02mol/L£¬HA-²æ·ÖµēĄė£¬ŌņøĆČÜŅŗÖŠĄė×ÓÅØ¶Č“óÓŚ0.04mol/L£»¢Ś0.02mol•L-1µÄNaHAČÜŅŗÖŠ£¬NaHAµēĄė³öµÄÄĘĄė×ÓĪŖ0.02mol/L£¬c£ØHA-£©ĪŖ0.02mol/L£¬ÓÉÓŚ¢ŁÖŠĒāĄė×ÓŅÖÖĘĮĖHA-µēĄė£¬Ōņ¢ŁÖŠĄė×ÓÅØ¶ČŠ”ÓŚ¢Ś£»¢ŪÅØ¶Č¾łĪŖ0.02mol•L-1µÄNa2AČÜŅŗŗĶNaHAµÄ»ģŗĻČÜŅŗÖŠ£¬Ąė×Ó×ÜÅØ¶Č“óÓŚ0.08mol/L£»¢Ü0.02mol•L-1µÄNa2AČÜŅŗÖŠĄė×ÓÅضČŌ¼ĪŖ0.06mol/L£¬ĖłŅŌĄė×ÓÅØ¶Č“óŠ”ĪŖ£ŗ¢Ū£¾¢Ü£¾¢Ś£¾¢Ł£¬¹ŹB“ķĪó£»
C£®øł¾ŻBµÄ·ÖĪöæÉÖŖ£¬ĒāĄė×ÓÅضČ×ī“óµÄĪŖ¢Ł£¬Ęä“ĪĪŖ¢Ś£¬×īŠ”µÄĪŖ¢Ü£¬ŌņĖÄÖÖČÜŅŗÖŠĒāĄė×ÓÅØ¶Č“óŠ”ĪŖ£ŗ¢Ł£¾¢Ś£¾¢Ū£¾¢Ü£¬¹ŹCÕżČ·£»
D£®øł¾ŻH2AČÜŅŗÖŠµÄµēŗÉŹŲŗćæÉÖŖ£ŗc£ØH+£©=c£ØHA-£©+2c£ØA2-£©+c£ØOH-£©£¬¹ŹD“ķĪó£»
¹ŹŃ”BD£®
µćĘĄ ±¾Ģāæ¼²éĮĖĄė×ÓÅØ¶Č“óŠ”±Č½Ļ£¬ĢāÄæÄѶČÖŠµČ£¬Ć÷Č·ŃĪµÄĖ®½āŌĄķ”¢Čõµē½āÖŹµÄµēĄė¼°ĘäÓ°ĻģĪŖ½ā“š¹Ų¼ü£¬×¢ŅāÕĘĪÕµēŗÉŹŲŗć”¢ŃĪµÄĖ®½āŌĄķŌŚÅŠ¶ĻĄė×ÓÅØ¶Č“óŠ”ÖŠµÄÓ¦ÓĆ·½·Ø£¬ŹŌĢāÅąŃųĮĖѧɜµÄĮé»īÓ¦ÓĆÄÜĮ¦£®


 Č«ÄܲāæŲŅ»±¾ŗĆ¾ķĻµĮŠ“š°ø
Č«ÄܲāæŲŅ»±¾ŗĆ¾ķĻµĮŠ“š°ø ·¢É¢Ė¼Ī¬ŠĀæĪĢĆĻµĮŠ“š°ø
·¢É¢Ė¼Ī¬ŠĀæĪĢĆĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā

²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | °¢·ü¼ÓµĀĀŽ³£ŹżµÄŹżÖµÓė12g 12CĖłŗ¬µÄĢ¼Ō×ÓŹżĻąµČ | |
| B£® | ŌŚ0.5mol Na2SO4 ÖŠ£¬ŗ¬ÓŠµÄNa+ ŹżŌ¼ŹĒ6.02”Į1023 | |
| C£® | µČĪļÖŹµÄĮæµÄO2 ÓėO3£¬Ėłŗ¬ŃõŌ×ÓŹżĻąµČ | |
| D£® | Ħ¶ūŹĒĪļÖŹµÄĮæµÄµ„Ī» |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | Va=Vb | B£® | Va£¾Vb | C£® | Va£¼Vb | D£® | ²»ÄÜČ·¶Ø |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
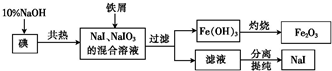
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | 1904Äź£¬µĄ¶ū¶ŁĢį³öĮĖŅ»øö±»³ĘĪŖ”°ĘĻĢŃøÉĆę°üŹ½”±µÄŌ×Ó½į¹¹Ä£ŠĶ | |
| B£® | ŌŚ»Æѧ·“Ó¦¹ż³ĢÖŠ£¬Ō×Ó×īĶā²ćµē×ÓŹż²»·¢Éś±ä»Æ£¬µ«Ō×ÓŗĖæÉÄÜ»į·¢Éś±ä»Æ | |
| C£® | ŌŚ»īĘĆ½šŹōÓė»īĘĆ·Ē½šŹōµÄ·“Ó¦ÖŠ£¬½šŹōŌŖĖŲµÄŌ×ӵƵ½µē×Ó£¬±ķĻÖĪŖøŗ»ÆŗĻ¼Ū | |
| D£® | Ō×Ó²»“ųµē£¬Ō×ÓµÄÖŹĮæÖ÷ŅŖ¼ÆÖŠŌŚŌ×ÓŗĖÉĻ |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com