
【题目】阿托酸是一种常用的医药中间体,合成路线如下:

(1)①的反应类型是_________;②的反应试剂和条件是________________。
(2)反应③是氧化反应,但有一个羟基没有被氧化。原因是___________________;
欲检验反应④的有机产物,可选择的试剂是________________________。
a. Na b. NaCl溶液 c. NaOH溶液 d. NaHCO3溶液
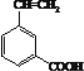
(3)写出反应⑤的化学方程式__________________________________;写出一种与阿托酸具有相同官能团的同分异构体的结构简式__________________。
(4)由CH2=CH-CHO和乙醇可以合成CH3CH2COOC2H5。写出其合成路线。____________
(合成路线常用的表示方式为:X![]() Y……
Y……![]() 目标产物)
目标产物)
【答案】 加成 氢氧化钠溶液、加热 羟基相连碳上没有氢原子,不能被氧化 d 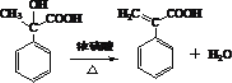
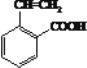 、
、 、
、 、
、  (写一个即可)
(写一个即可) ![]()
【解析】(1)通过分析可知:有机物 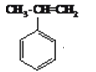 与溴化氢发生加成反应生成有机物A,为溴代烃,在氢氧化钠溶液中加热发生取代反应生成
与溴化氢发生加成反应生成有机物A,为溴代烃,在氢氧化钠溶液中加热发生取代反应生成 ;正确答案:加成 ;氢氧化钠溶液、加热 。
;正确答案:加成 ;氢氧化钠溶液、加热 。
(2) 发生催化氧化,变为
发生催化氧化,变为  ;但有一个羟基没有被氧化,原因羟基相连碳上没有氢原子,不能被氧化;有机物④为
;但有一个羟基没有被氧化,原因羟基相连碳上没有氢原子,不能被氧化;有机物④为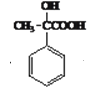 ,羧基能够和NaHCO3溶液反应放出气体,可以用NaHCO3溶液来检验;正确答案:羟基相连碳上没有氢原子,不能被氧化;d。
,羧基能够和NaHCO3溶液反应放出气体,可以用NaHCO3溶液来检验;正确答案:羟基相连碳上没有氢原子,不能被氧化;d。
(3)反应⑤在浓硫酸作用下,发生消去反应生成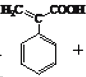 ;反应方程式为
;反应方程式为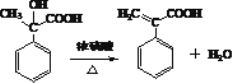 ;与阿托酸具有相同官能团的同分异构体有4种:
;与阿托酸具有相同官能团的同分异构体有4种:
一个取代基的为: ;2个取代基为
;2个取代基为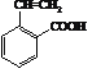 、
、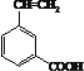 、
、 ;正确答案:
;正确答案: 
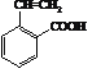 、
、 、
、 、
、  (写一个即可)。
(写一个即可)。
(4)CH2=CH-CHO被银氨溶液氧化为CH2=CHCOOH,该有机物再与氢气发生加成反应生成CH3CH2COOH,CH3CH2COOH与乙醇发生酯化反应生成酯;具体流程如下:![]() ;正确答案:
;正确答案:![]()


 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案 品学双优卷系列答案
品学双优卷系列答案 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】![]() 为阿伏加德罗常数,下列叙述中正确的是( )
为阿伏加德罗常数,下列叙述中正确的是( )
A. 常温常压下,46g![]() 与
与![]() 混合气体共含3
混合气体共含3![]() 个原子
个原子
B. 标准状况下,22.4L甲醇中含有的氧原子数目为1.0![]()
C. 100℃时,1L pH=6的纯水中,含有的![]() 数目为
数目为![]()
![]()
D. 常温下0.1mol![]() 与过量稀NaOH溶液反应,转移的电子总数为0.2
与过量稀NaOH溶液反应,转移的电子总数为0.2![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电化学原理在防止金属腐蚀、能量转换、物质合成等方面应用广泛. 
(1)为了减缓海水对钢闸门A和C的腐蚀,图1中,材料B可以选择(填字母序号). a.锌板 b.铜板 c.碳棒
图2中,钢闸门C作极.若用氯化钠溶液模拟海水进行实验,D为石墨块,则D上的电极
反应式为 , 检测该电极反应产物的试剂是 .
(2)微生物电池是指在微生物的作用下将化学能转化为电能的装置,其工作原理如图3所示(质子交换膜只允许H+自由通过).该电池的正极反应式为 .
(3)电渗析法处理厨房垃圾发酵液,同时得到乳酸(弱酸)的原理如图4所示(图中“HA”表示乳酸 分子,A﹣表示乳酸根离子).
①阳极的电极反应式为 .
②简述浓缩室中得到浓乳酸的原理: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】a、b、c、d、e、f为六种原子序数依次增大前20号主族元素,a、b、c、d位于同周期,b、f位于同主族,其中a、b、f 为金属元素,c的最外层电子数是其次外层电子数的3倍,c与f 的原子序数和是e的2倍。下列说法错误的是
A. 原子半径a>b>c>d
B. 最简单气态氢化物的稳定性e<c<d
C. 最高价氧化物对应的水化物的碱性f>b
D. fc2、ec2两种化合物中c的化合价相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上有一种用CO2来生产甲醇燃料的方法:CO2(g)+3H2(g)CH3OH(g)+H2O(g)△H=﹣49.0kJmol﹣1 , 将6mol CO2和8mol H2充入2L的密闭容器中,测得H2的物质的量随时间变化如图所示(实线).图中数据a(1,6)表示:在1min时H2的物质的量是6mol. 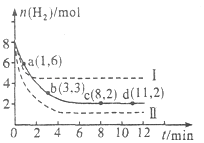
(1)a点正反应速率(填“大于”“等于”或“小于”)逆反应速率.
(2)下列时间段平均反应速率最大的是 .
A.O~1min
B.1~3min
C.3~8min
D.8~11min
(3)仅改变某一实验条件再进行两次实验测得H2的物质的量随时间变化如图中所示(虚线).曲线I对应的实验条件改变是 , 曲线Ⅱ对应的实验条件改变是 , 体积不变再充入3molCO2和4mol H2 , H2O(g)的体积分数(填“增大”“不变”或“减小”).
(4)若将1molCO2和3molH2充入该容器中,充分反应达到平衡后,若CO2转化率为a,则容器内的压强与起始压强之比为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验的叙述正确的是

A. 用图1装置将氯化铁溶液直接蒸干得到氯化铁固体
B. 利用图2装置可制备Fe(OH)2
C. 图3微热稀HNO3片刻,溶液中有气泡产生,广口瓶内始终保持无色
D. 利用图4可收集氯化氢并进行尾气吸收
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列4种物质:①NO;②SiO2;③Cl2;④FeCl3,能与O2反应生成红棕色气体的是__________(填序号,下同);其水溶液具有漂白性的是___________;能与强碱反应的氧化物是_______;遇KSCN溶液变红色的是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磁性纳米四氧化三铁在催化剂、DNA检测、疾病的诊断和治疗等领域应用广泛,其制备方法有多种,“共沉淀法”制备纳米Fe3O4的流程如下:

(1)Ⅱ中的反应温度需控制在50℃~60℃之间,实验室控制该温度的最佳方法是____。
(2)Ⅱ中生成Fe3O4的离子方程式是__________。
(3)操作Ⅲ包含的方法有______、洗涤。
(4)某同学依据上述“共沉淀法”的思路在实验室模拟制备纳米Fe3O4,当混合溶液中n(Fe3+)∶n(Fe2+)=1∶1时,容易得到理想的纳米Fe3O4。该实验室无FeCl2溶液,现用5mLFeCl3溶液制备Fe3O4,配制n(Fe3+)∶n(Fe2+)=1∶1混合溶液的方法是____________(其它试剂自选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上常用隔膜电解法将乙醛转化为乙醇和乙酸来处理高浓度乙醛废水。探究性学习小组用如图所示装置电解一定浓度的乙醛-Na2SO4溶液,模拟乙醛废水的处理过程。下列说法正确的是
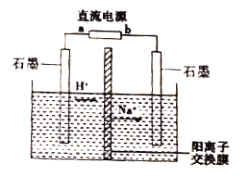
A. a 为直流电源的负极
B. 阳极的电极反应为:CH3CHO-2e-+H2O=CH3COOH+2H+
C. 电解过程中,阴极区的pH逐渐减小
D. 理论上阳极区处理废水的能力是阴极区的两倍
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com