
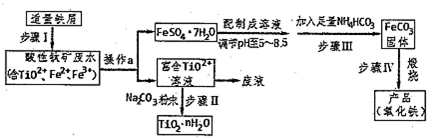
分析 钛矿工业中的酸性废水富含Ti、Fe等元素,含有TiO2+、Fe2+、Fe3+等离子,加入铁粉还原铁离子得到亚铁离子,通过蒸发浓缩、冷却结晶过滤洗涤、干燥得到硫酸亚铁晶体,配制成溶液调节溶液pH5-5.8范围内,加入足量碳酸氢铵,过滤得到碳酸亚铁沉淀,在坩埚中灼烧得到氧化铁,过滤后得到富含的TiO2+溶液,加入Na2CO3粉末与H+反应,降低了溶液中c(H+),使平衡TiO2++(n+1)H2O?TiO2•n H2O+2H+向生成TiO2•n H2O的方向移动,可得到TiO2粗产品,
(1)离子中个元素化合价代数和等于离子所带电荷数计算,元素为-2价;
(2)通过检验是否含铁离子来判断步骤I中检验钛矿废水中加入铁屑是否足量;
(3)溶液中得到溶质固体的方法是蒸发浓缩、冷却结晶、过滤;
(4)反应温度一般需控制在35℃以下,是为了避免温度过高碳酸氢铵分解,减少铁离子的水解程度;
(5)根据溶液中c(Fe2+)•c(OH-)2与Ksp[Fe(OH)2]比较,可判断有无Fe(OH)2沉淀,保证二价铁被氧化为三价需要多通入空气或氧气;
(6)富含的TiO2+溶液,加入Na2CO3粉末与H+反应,降低了溶液中c(H+),使平衡TiO2++(n+1)H2O?TiO2•n H2O+2H+向生成TiO2•n H2O的方向移动;
(7)步骤Ⅰ所得溶液中含有难溶物Fe,在步骤a操作前最好将过量的铁粉除去.
解答 解:钛矿工业中的酸性废水富含Ti、Fe等元素,含有TiO2+、Fe2+、Fe3+等离子,加入铁粉还原铁离子得到亚铁离子,通过蒸发浓缩、冷却结晶过滤洗涤、干燥得到硫酸亚铁晶体,配制成溶液调节溶液pH5-5.8范围内,加入足量碳酸氢铵,过滤得到碳酸亚铁沉淀,在坩埚中灼烧得到氧化铁,过滤后得到富含的TiO2+溶液,加入Na2CO3粉末与H+反应,降低了溶液中c(H+),使平衡TiO2++(n+1)H2O?TiO2•n H2O+2H+向生成TiO2•n H2O的方向移动,可得到TiO2粗产品,
(1)离子中个元素化合价代数和等于离子所带电荷数计算,元素为-2价,则TiO2+钛的化合价为+4价,
故答案为:+4;
(2)步骤I中检验钛矿废水中加入铁屑是否足量的试剂是检验是否含铁离子,可以选择加入NaOH溶液或KSCN溶液,如:加入硫氰化钾后溶液变红色证明铁加入不足,如溶液不变红色证明铁粉加入足量,
故答案为:BD;
(3)操作a是溶液中得到溶质固体,方法是蒸发浓缩、冷却结晶过滤;操作a用到的玻璃仪器有:玻璃杯、酒精灯和漏斗,
故答案为:过滤;玻璃杯、酒精灯和漏斗;
(4)步骤Ⅲ中发生反应是硫酸亚铁和碳酸氢铵反应生成碳酸亚铁充电、硫酸铵、二氧化碳和水,反应的化学方程式为:FeSO4+2NH4HCO3=FeCO3↓+(NH4)2SO4+H2O+CO2↑,为了避免温度过高碳酸氢铵分解、减少铁离子的水解程度,反应温度一般需控制在35℃以下,
故答案为:避免温度过高碳酸氢铵分解,减少铁离子的水解程度;
(5)室温下测得溶液的pH为8.5,c(OH-)=$\frac{1{0}^{-14}}{1{0}^{-8.5}}$=1×10-5.5,由题中数据可知,溶液中c(Fe2+)•c(OH-)2=1×10-6×(1×10-5.5)2=1×10-17<Ksp[Fe(OH)2]=8×10-16,故无Fe(OH)2沉淀生成,
故答案为:没有;向容器中补充适量的空气;
(6)富含的TiO2+溶液,加入Na2CO3粉末与H+反应,降低了溶液中c(H+),使平衡TiO2++(n+1)H2O?TiO2•n H2O+2H+向生成TiO2•n H2O的方向移动,可得到TiO2粗产品,
故答案为:溶液中存在水解平衡TiO2++(n+1)H2O?TiO2•n H2O+2H+,加入的Na2CO3粉末与H+反应,降低了溶液中c(H+),促进水解平衡向生成TiO2•n H2O的方向移动;
(7)步骤Ⅰ所得溶液中含有过量的铁粉,为了避免过滤得到碳酸亚铁沉淀混有铁粉,在a操作前最好增加过滤操作,
故答案为:过滤.
点评 本题考查化学实验基本操作方法的综合应用,为高考常见题型,题目浓度较大,侧重于学生的分析能力、实验能力的考查,注意把握实验的原理和目的,为解答该类题目的关键,注意物质的性质,结合题给信息解答,试题有利于提高学生的分析、理解能力及化学实验能力.


科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验事实 | 解释 |
| A | 加热蒸干MgSO4溶液能得到MgSO4固体;加热蒸干MgCl2溶液得不到MgCl2固体 | H2SO4不易挥发,HCl易挥发 |
| B | 电解CuCl2溶液,阴极得到Cu;电解NaCl溶液,阴极得不到Na | 得电子能力:Cu2+>Na+>H+ |
| C | 浓HNO3能氧化NO;稀HNO3不能氧化NO | HNO3浓度越大,氧化性越强 |
| D | 钠与乙醇反应平缓;钠与水反应剧烈 | 羟基中氢的活性:C2H5OH<H2O |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 6种 | B. | 5种 | C. | 4种 | D. | 3种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
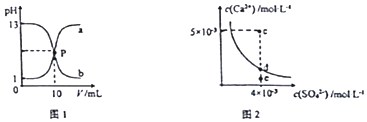
| A. | 图1中P点溶液:c(Na+ )=c(Cl-)>c(H+ )=c(OH- ) | |
| B. | 由图1可知盐酸和NaOH溶液的浓度均为1mol•L-1 | |
| C. | 图2中c点有沉淀生成,达平衡后溶液中c(SO42- )=3×10-3 mol•L-1 | |
| D. | 可通过蒸发将图 2中e点的溶液变到d点 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验 | 现象 | 结论 |
| A | 向某无色溶液中滴加氯水后,再滴加淀粉溶液 | 溶液变为蓝色 | 原溶液为KI溶液 |
| B | 向10mL浓度均为0.1mol/L的MgCl2和CuCl2的混合溶液中滴加一滴0.1mol/L的NaOH溶液 | 出现蓝色沉淀 | Ksp[Mg(OH)2]>Ksp[Cu(OH)2] |
| C | 向某未知溶液中滴加稀盐酸后产生无色气体,气体通入品红溶液中 | 品红溶液褪色 | 原溶液中有SO32- |
| D | 用刚洗净未干燥的容量瓶配制0.1mol/L的NaOH溶液 | 所配制的溶液浓度偏小 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| W | Y | |
| X | Z |
| A. | 若W的氧化物为WO2,则Z的最高价含氧酸一定为H2ZO4 | |
| B. | 若X的单质可作半导体材料,则Y的氢化物的水溶液一定显碱性 | |
| C. | 原子半径大小顺序一定为X>Z>Y>W | |
| D. | 最高正化合价大小顺序一定为Y=Z>X>W |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
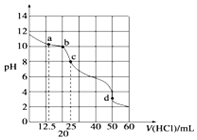 在常温下,0.10mol•L-1Na2CO3溶液25mL 用0.10mol•L-1盐酸滴定,其滴定曲线如图.对滴定过程中所得溶液中相关离子浓度间的关系,下列有关说法正确的是( )
在常温下,0.10mol•L-1Na2CO3溶液25mL 用0.10mol•L-1盐酸滴定,其滴定曲线如图.对滴定过程中所得溶液中相关离子浓度间的关系,下列有关说法正确的是( )| A. | a点:c(CO32-)=c(HCO-3)>c(OH-) | B. | b点:5c(Cl-)>4c(HCO-3)+4c(CO2-3) | ||
| C. | c点:c(OH-)=c(H+)+c(HCO-3)+2c(H2CO3) | D. | d点:c(H+)=c(CO2-3)+c(HCO-3)+c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 反应②中反应物所具有的总能量大于生成物所具有的总能量 | |
| B. | 2N2H4(g)+2NO2(g)=3N2(g)+4H2O(l)△H=-1135.7 kJ/mol | |
| C. | 铂作电极,KOH溶液作电解质溶液,由反应②设计的燃料电池,当电路中转移0.16mole-,生成N211.2g | |
| D. | 铂作电极,Na2SO4作电解质溶液,由反应②设计的燃料电池,工作一段时间后恢复至原温度,Na2SO4溶液的pH不变 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com