
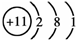 .
.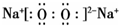 .
.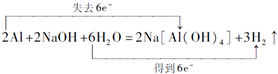 .
. 分析 A元素原子核外只有1个电子,则A为H元素;B元素原子最外层上的电子数为次外层电子数的2倍,原子只能有2个电子层,最外层电子数为4,则B为碳元素;B元素原子和C元素原子最外层电子数之差为2,且C的原子序数较大,故C为O元素;B、C、D三种元素可以形成化学式D2BC3的化合物,其焰色反应为黄色,则D为Na;0.5 mol E元素的单质与足量的酸反应有9.03×1023个电子发生转移,转移电子为1.5mol,则E为+3价,在E和C的化合物为E2O3,其中E的质量占52.94%,设E的相对原子质量为x,则:$\frac{2x}{2x+48}$=52.94%,解得x=27,又已知E的原子核中有14个中子,则E的质子数为27-14=13,故E为Al,据此解答.
解答 解:A元素原子核外只有1个电子,则A为H元素;B元素原子最外层上的电子数为次外层电子数的2倍,原子只能有2个电子层,最外层电子数为4,则B为碳元素;B元素原子和C元素原子最外层电子数之差为2,且C的原子序数较大,故C为O元素;B、C、D三种元素可以形成化学式D2BC3的化合物,其焰色反应为黄色,则D为Na;0.5 mol E元素的单质与足量的酸反应有9.03×1023个电子发生转移,转移电子为1.5mol,则E为+3价,在E和C的化合物为E2O3,其中E的质量占52.94%,设E的相对原子质量为x,则:$\frac{2x}{2x+48}$=52.94%,解得x=27,又已知E的原子核中有14个中子,则E的质子数为27-14=13,故E为Al.
(1)B元素的名称为碳,D为Na原子,原子的结构示意图为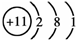 ,故答案为:碳;
,故答案为:碳;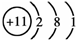 ;
;
(2)D2C2为Na2O2,电子式为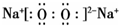 ,故答案为:
,故答案为: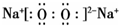 ;
;
(3)Na2O2与H2O反应的化学方程式:2Na2O2+2H2O=4NaOH+O2↑,故答案为:2Na2O2+2H2O=4NaOH+O2↑;
(4)Al与NaOH溶液反应的电子转移的方向和数目为: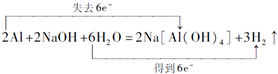 ,
,
故答案为: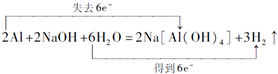 .
.
点评 本题考查结构性质位置关系应用,侧重对化学用语的考查,推断元素是解题关键,注意对基础知识的理解掌握.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
 如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.
如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠与水反应:Na+2H2O═Na++2OH-+H2↑ | |
| B. | 向Al2(SO4)3溶液中加入过量NH3?H2O:Al3++4NH3?H2O═AlO2-+4NH4++2H2O | |
| C. | 酸性溶液中KClO3与KCl反应生成Cl2:ClO3-+Cl-+6H+═Cl2↑+3H2O | |
| D. | 向含1molNaHSO3的溶液中加入1molNa2O2:Na2O2+HSO3-═2Na++SO42-+OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 若关闭K2、打开K1,一段时间后,发现左侧试管收集到的气体比右侧略多,则a为正极,b为负极 | |
| B. | 关闭K2,打开K1,一段时间后,用拇指堵住试管移出烧 杯,向试管内滴入酚酞,发现左侧试管内溶液变红色,则 a为负极,b为正极 | |
| C. | 若直流电源a为负极,b为正极,关闭K2,打开K1,一段时间后,再关闭K1,打开K2,则电路中电流方向为从右侧石墨棒沿导线到左侧石墨棒 | |
| D. | 若直流电源a为负极,b为正极,关闭K2,打开K1,一段时间后,再关闭K1,打开K2,则左侧石墨棒上发生的电极反应为H2-2e-+2OH-═2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 太阳能、地热能、核能、化石燃料等均属于“新能源” | |
| B. | 减少含碳物质做燃料符合“低碳”理念 | |
| C. | 图中转化途径不能体现“节能减排”的思想 | |
| D. | 节约用电不能减少CO2的排放量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 核能的利用可能会造成放射性污染,应该立即关闭所有核电站 | |
| B. | 中国古代利用明矾溶液的酸性清除铜镜表面的铜锈 | |
| C. | 泡沫灭火器中使用了盐类水解的原理 | |
| D. | 宁德新能源公司生产的锂离子电池可以将化学能转化为电能 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4(g)+$\frac{3}{2}$O2(g)═CO(g)+2H2O(l)△H=-890.3kJ•mol-1 | |
| B. | CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3kJ•mol-1 | |
| C. | CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=+890.3kJ•mol-1 | |
| D. | CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890.3kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
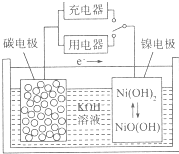
| A. | 放电时,正极质量增加 | |
| B. | 充电时,溶液中OH-移向碳电极 | |
| C. | 充电时,将电池的碳电极与外电源的负极相连 | |
| D. | 放电时,电路中每转移2mol电子,碳电极上有1molH2被还原 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 冰晶石(Na3AlF6)是工业上冶炼铝的助熔剂,制取冰晶石(Na3AlF6)的化学方程式为:2Al(OH)3+12HF+3Na2CO3═2Na3AlF6+3CO2↑+9H2O.根据题意完成下列填空:
冰晶石(Na3AlF6)是工业上冶炼铝的助熔剂,制取冰晶石(Na3AlF6)的化学方程式为:2Al(OH)3+12HF+3Na2CO3═2Na3AlF6+3CO2↑+9H2O.根据题意完成下列填空:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com