NO2被誉为生命的“信息分子”,铵盐为植物生长的“食物”,氮及其化合物在工农业生产和生命活动中起着重要的作用。
(1)在100℃时,将0.100 mol的N2O4气体充入1L恒容抽空的密闭容器中,隔一定时间对该容器内物质的浓度进行分析得到下表数据:
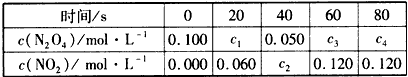
①从表中分析:该温度下,反应N
2O
4(g)
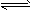
2NO
2(g) 的平衡常数为_______,N
2O
4的转化率为______。
②在上述条件下,60s内N
2O
4的平均反应速率为__________mol/(L·s)。
③达平衡后下列条件的改变可使NO
2浓度增大的是__________
A.增大容器的容积
B.再充入一定量的N
2O
4
C.再充入一定量的NO
2
D.再充入一定量的He
(2)氨气与硝酸反应可生成硝酸铵,NH
4NO
3热分解反应的方程式及反应热分别为(注:kJ/g也是反应热的单位):
NH
4NO
3(s)=N
2O(g)+2H
2O (l) △H=-0.53 kJ/g ①
NH
4NO
3(s)=N
2(g)+1/2O
2(g)+2H
2O(l) △H=-1.47 kJ/g ②
则2N
2O(g)=2N
2(g)+O
2(g)的△H=__________kJ/mol。

 2NO2(g) 的平衡常数为_______,N2O4的转化率为______。
2NO2(g) 的平衡常数为_______,N2O4的转化率为______。