
| A、0.1mol?L-1 NaHCO3溶液中:c(OH-)=c(H+)+c(H2CO3)-c(CO32-) |
| B、0.1mol?L-1 NH4Cl溶液中:c(Cl-)=c(NH4+)+c(NH3?H2O)=0.1mol?L-1 |
| C、pH=2的HA溶液与pH=12的MOH溶液任意比混合:c(H+)+c(M+)=c(OH-)+c(A-) |
| D、常温下,浓度为0.1mol?L-1 NaHSO3溶液的pH<7:c(Na+)>c(HSO3-)>c(SO32-)>c(H+) |


 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案科目:高中化学 来源: 题型:
| A、水泥冶金厂常用高压电除去工厂烟尘,利用了胶体的性质 |
| B、煤的气化和煤的液化都可以使煤变为清洁能源,煤的气化和煤的液化都属于物理变化 |
| C、我国首艘航母“辽宁舰”上用于舰载机降落的拦阻索是特种钢缆,属于金属材料 |
| D、页岩气是从页岩层中开采出来的天然气.由于产气的页岩分布广、厚度大,且普遍含气,故可以成为新的化石燃料来源 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 根据如图提供的信息,下列所得结论不正确的是( )
根据如图提供的信息,下列所得结论不正确的是( )| A、该反应为放热反应 |
| B、该反应一定有能量转化成了化学能 |
| C、反应物比生成物稳定 |
| D、因为生成物的总能量高于反应物的总能量,所以该反应不需要加热 |
查看答案和解析>>
科目:高中化学 来源: 题型:
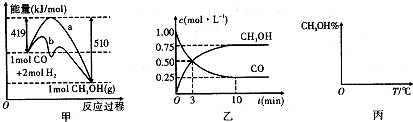
| n(CH3OH) |
| n(CO) |
查看答案和解析>>
科目:高中化学 来源: 题型:

浓度/mol?L-1 时间/min | NO | N2 | CO2 |
| 0 | 0.100 | 0 | 0 |
| 10 | 0.058 | 0.021 | 0.021 |
| 20 | 0.040 | 0.030 | 0.030 |
| 30 | 0.040 | 0.030 | 0.030 |
| 40 | 0.032 | 0.034 | 0.017 |
| 50 | 0.032 | 0.034 | 0.017 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com