
【题目】常温下,下列说法正确的是![]()
A.pH值都为4的稀盐酸和![]() 溶液中,水的电离程度相同
溶液中,水的电离程度相同
B.浓度均为![]() 的醋酸和NaOH溶液等体积混合后:
的醋酸和NaOH溶液等体积混合后:
C.在含浓度都为![]() 的
的![]() 、
、![]() 的混合溶液中滴加
的混合溶液中滴加![]() 溶液,先出现沉淀的是
溶液,先出现沉淀的是![]() 已知:
已知:![]() ,
,![]()
D.浓度均为![]() 的
的![]() 和
和![]() 溶液中,
溶液中,![]() 相同
相同
【答案】C
【解析】
A. 稀盐酸中水的电离受到抑制,NH4Cl溶液中水的电离受到促进,所以两种溶液中水的电离程度不相同,故A错误;
B. 浓度均为0.1mol/L的醋酸和NaOH溶液等体积混合后恰好完全反应,得到醋酸钠溶液,醋酸根离子水解使溶液呈碱性,c(H+)<c(OH-),所以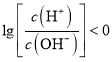 ,故B错误;
,故B错误;
C. AgCl饱和所需Ag+浓度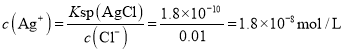 ,
,
Ag2CrO4饱和所需![]() 浓度
浓度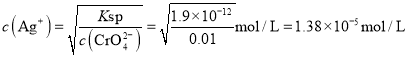 ,因为
,因为![]() ,所以
,所以![]() 先沉淀,故C正确;
先沉淀,故C正确;
D. 浓度均为0.1mol/L的NH4Cl和CH3COONH4溶液中,铵根离子浓度因水解而减小,由于CH3COO-水解消耗NH4+水解产生的H+,促进NH4+水解,所以CH3COONH4溶液中,c(NH4+)较小,故D错误;
答案选C。


科目:高中化学 来源: 题型:
【题目】已知可逆反应X(g)+2Y(g)Z(g)△H<0,一定温度下,在体积为2L的密闭容器中加入4mol Y和一定量的X后,X的浓度随时间的变化情况如图所示,则下列表述正确的是( )

A. 达到平衡时,X、Y、Z物质的量之比为1:2:1
B. a点正反应速率大于逆反应速率
C. 反应达平衡时,降低温度可以实现c到d的转化
D. 该条件下,反应达平衡时,X平衡转化率为25%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某化学反应A2(g)+2B2(g)=2AB2(g) (A2、B2、AB2的结构式分别为A=A、B-B、B-A-B),能量变化如图所示,下列有关叙述中正确的是
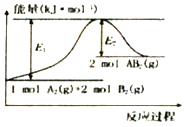
A. 该反应若生成2molAB2(g)则吸收的热量为(El-E2)kJ
B. 该反应的进行一定需要加热或点燃条件
C. 该反应断开化学键消耗的总能量小于形成化学键释放的总能量
D. 生成2molB-B键放出E2kJ能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】还原沉淀法是处理含铬![]() 和
和![]() 废水常用方法,过程如下:CrO42-
废水常用方法,过程如下:CrO42-![]()
Cr2O72-![]() Cr3+
Cr3+![]() Cr(OH)3 ,已知废水中Cr的含量为
Cr(OH)3 ,已知废水中Cr的含量为![]() ,当溶液中离子浓度小于
,当溶液中离子浓度小于![]() 时认为离子已经沉淀完全,常温下,
时认为离子已经沉淀完全,常温下,![]() 有关叙述中不正确的是
有关叙述中不正确的是
A.上述三个转化中只有一个涉及氧化还原反应
B.第二步离子方程式为:![]()
C.处理含铬废水可使用强碱![]() ,也可以使用弱碱氨水
,也可以使用弱碱氨水
D.当![]() 时,废水中铬元素沉淀完全
时,废水中铬元素沉淀完全
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式中ΔH能表示可燃物燃烧热的是( )
A.2H2(g) + O2(g) = 2H2O(g) ΔH= -483.6kJ·mol-1
B.CO(g) +![]() O2(g) = CO2(g) ΔH= -283kJ·mol-1
O2(g) = CO2(g) ΔH= -283kJ·mol-1
C.CH4(g) + 2O2(g) = CO2(g) +2H2O(g) ΔH= -802kJ·mol-1
D.C(s) +![]() O2(g) = CO(g) ΔH= -108kJ·mol-1
O2(g) = CO(g) ΔH= -108kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应:FeO(s)+CO(g) = Fe(s)+CO2(g) 的Kc=0.5(1273K)。若起始浓度c(CO)=0.05 mol/L,c(CO2)=0.01 mol·L-1,请回答:
(1)判断化学反应进行的方向并计算反应物、生成物的平衡浓度。
(2)CO的转化率是多少?
(3)增加FeO的量,对平衡有无影响?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表中实验操作、现象以及所得出的结论都正确的是![]()
选项 | 实验操作 | 实验现象 | 实验结论 |
A | 向盛有 | 先出现白色沉淀,后出现黄色沉淀 |
|
B | 将适量 | 一支试管出现白色沉淀,另一支试管无明显现象 | 出现的白色沉淀是 |
C | 取少量 | 产生白色沉淀 |
|
D | 湿润的KI淀粉试纸靠近气体Y | 试纸变蓝 | Y可能是 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A是由导热材料制成的密闭容器,B是一耐化学腐蚀且易于传热的气球。关闭K2,将等量且少量的NO2通过K1、K3分别充人A、B中,反应起始时,A、B的体积相同。(已知:2NO2 ![]() N2O4;△H<0)
N2O4;△H<0)

(1)一段时间后,反应达到平衡,此时A、B中生成的N2O4的速率是VA_______VB。(填“>”、“<”、“=”);若打开活塞K2,气球B将___________(填:变大、变小、不变)。
(2)若在A、B中再充入与初始量相等的NO2,则达到平衡时,NO2的转化率αA将______(填增大或减小、不变);若通入等量的Ne气,则达到平衡时,A中NO2的转化率将_____,B中NO2的转化率将_______(填: 变大、变小、不变)。
(3)室温下,若A、B都保持体积不变,将A套上一个绝热层,B与外界可以进行热传递,则达到平衡时,___________中的颜色较深。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】大力发展电动汽车,可以有效控制空气污染。目前机动车常使用的电池有铅蓄电池、锂电池等。
I.铅蓄电池充放电的总反应为:PbO2+Pb+2H2SO4![]() 2PbSO4+2H2O。锂硫电池充放电的总反应为:2Li+S
2PbSO4+2H2O。锂硫电池充放电的总反应为:2Li+S![]() Li2S。
Li2S。
(1)铅蓄电池的负极材料为________________________。
(2)当消耗等质量的负极活性物质时,锂硫电池的理论放电量是铅蓄电池的___________倍。(保留三位有效数字)
II.由方铅矿(PbS)制备铅蓄电池电极材料(PbO2)的方法如下:

(3)步骤①酸溶时,为提高酸溶速率,可采取的措施是____________ (任写一条)。
(4)已知 25℃时,Ksp(PbSO4)=1.82×10-8,Ksp(PbCO3)=1.46×10-13。若步骤②沉铅后的滤液中c(Pb2+)=1.82×10-6 mol·L-1,则此时c(![]() )=_____________ mol·L-1。
)=_____________ mol·L-1。
(5)步骤③向PbSO4中加Na2CO3溶液会发生:PbSO4(s)+![]() (aq)=PbCO3(s)+
(aq)=PbCO3(s)+![]() (aq)。列式并计算该反应此温度下的平衡常数K=______________(写出K的表达式、代入数据、算出结果、保留三位有效数字)
(aq)。列式并计算该反应此温度下的平衡常数K=______________(写出K的表达式、代入数据、算出结果、保留三位有效数字)
(6)以石墨为电极电解Pb(NO3)2溶液也可以制得PbO2。PbO2将在__________极生成(填“阴”或“阳”);而另一极存在电极反应Pb2++2e-=Pb,故Pb元素的利用率较低。若在Pb(NO3)2溶液中加入适量Cu(NO3)2则可有效利用Pb2+,其理由是_____________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com