
425 ℃时,在1 L密闭容器中充入下列气体物质进行反应达到平衡,分析下面示意图,从下列选项中选出不能从示意图中读出的相关信息是 ( )。
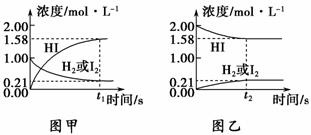
A.同温同压下,只要物质比例适当,从正、逆方向都可以建立同一平衡状态
B.图甲表示的反应为H2(g)+I2(g)2HI(g)
C.图甲中H2的转化率+图乙中HI的转化率=100%
D.相同条件下,分别从正、逆方向建立等同的平衡状态,所需时间相同
 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案科目:高中化学 来源: 题型:
我国三峡工程所提供的清洁、廉价、强劲、可再生的水电,相当于每年燃烧3×106t原煤的火力发电厂产生的电能。因此,三峡工程有助于控制 ( )
A.温室效应和酸雨 B.赤潮 C.白色污染 D.破坏大气臭氧层
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述正确的是( )
①铁能被磁铁吸引 ②在人体的血红蛋白中含有铁元素 ③镁在空气中可剧烈燃烧,并发出强光 ④铁能在氧气中剧烈燃烧,生成黑色的Fe3O4 ⑤在空气中加热铜可生成黑色的CuO
A.①②④⑤ B.②③④⑤ C.①③④⑤ D.全部
查看答案和解析>>
科目:高中化学 来源: 题型:
甲醇广泛用作燃料电池的燃料,可用天然气来合成,已知:
①2CH4(g)+O2(g)===2CO(g)+4H2(g) ΔH=-71 kJ·mol-1
②CO(g)+2H2(g)===CH3OH(l) ΔH=-90.5 kJ·mol-1
③CH4(g)+2O2(g)===CO2(g)+2H2O(l) ΔH=-890 kJ·mol-1
下列说法不能得出的结论是( )
A.反应②不需要加热就能进行
B.CO(g)+2H2(g)===CH3OH(g) ΔH>-90.5 kJ·mol-1
C.甲醇的燃烧热ΔH=-764 kJ·mol-1
D.若CO的燃烧热ΔH=-283.0 kJ·mol-1,则H2的燃烧热ΔH=-285.8 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
对于可逆反应2CO(g)+2NO(g)N2(g)+2CO2(g) ΔH<0,下列说法正确的是 ( )。
A.加入催化剂,平衡正向移动
B.在恒温、恒容条件下,加入氢氧化钠,平衡不移动
C.在恒温、恒压条件下,通入He气,平衡不移动
D.降温,平衡正向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述中正确的是( ) 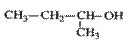
A. 的命名为:2-甲基-1-丙醇
B.软脂酸和油酸互为同系物
C.聚乙烯能使溴水褪色
D.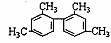 分子中至少有11个碳原子处于同一平面
分子中至少有11个碳原子处于同一平面
查看答案和解析>>
科目:高中化学 来源: 题型:
CO和H2的混合气体俗称合成气,是一种重要的工业原料气,工业上利用天
然气(主要成分为CH4)与水进行高温重整制备合成气。
⑴ 已知:CH4、H2和CO的燃烧热(△H)分别为-890.3kJ/mol、-285.8kJ/mol和
-283.0kJ/mol,且1mol液态水汽化时的能量变化为44.0kJ。用1 m3(标准状况)的
甲烷与水蒸气在高温下反应制取合成气所需的热量为 (保留整数)。
⑵ 在一定温度下,向体积为2L的密闭容器中充入0.40mol CH4和0.60mol H2O(g),测得
CH4(g)和H2(g)的物质的量浓度随时间变化如下表所示:
|

 | 0 | 1 | 2 | 3 | 4 | ||||||
| CH4 | 0.2mol·L-1 | 0.13 mol·L-1 | 0.1 mol·L-1 | 0.1 mol·L-1 | 0.09 mol·L-1 | ||||||
| H2 | 0 mol·L-1 | 0.2 mol·L-1 | 0.3 mol·L-1 | 0.3 mol·L-1 | 0.33 mol·L-1 |
①计算该反应第一次达平衡时的平衡常数K 。
②3min时改变的反应条件是 (只填一种条件的改变即可)。
⑶ 已知温度、压强、投料比X对该反应的影响如图所示。

①图1中的两条曲线所示投料比的关系X1 X2(填“=”、“>”或“<”下同)。
②图2中两条曲线所示的压强比的关系:P1 P2。
⑷ 以天然气(设杂质不参与反应)、KOH溶液为原料可设计成燃料电池:
①放电时,负极的电极反应式为 。
②设装置中盛有100.0mL 3.0mol/L KOH溶液,放电时参与反应的氧气在标准状况下
的体积为8.96L,放电过程中没有气体逸出,则放电完毕后,所得溶液中各离子浓度由大到小的关系为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
有一学生在实验室测某溶液的pH。实验时,他先用蒸馏水润湿pH试纸,然后用洁净干燥的玻璃棒蘸取试样进行检测。
(1)该学生的操作是__________(填“正确”或“错误”)的,其理由是
________________________________________________________________________。
(2)如不正确,请分析是否一定有误差
________________________________________________________________________
________________________________________________________________________
________________________________________________________________________
________________________________________________________________________。
(3)若用此法分别测定[H+]相等的盐酸和醋酸溶液的pH,误差较大的是__________,原因是________________________________________________________________________
________________________________________________________________________
________________________________________________________________________
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下表为元素周期表的一部分,参照元素①~⑦在表中的位置,请用化学用语回答下列问题。
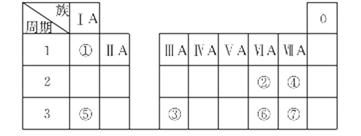
(1)④、⑤、⑦的原子半径由大到小的顺序为______________(用元素符号表示)。
(2)⑥和⑦的最高价含氧酸的酸性强弱为________>__________
(3)④、⑥、⑦的气态氢化物的稳定性由弱到强的顺序是_______________。
(4)①、②两种元素按原子个数之比为1:1组成的常见液态化合物,在酸性溶液中能将Fe2+氧化,写出该反应的离子方程式_______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com