
下列叙述正确的是( )
A.无论是纯水,还是酸性、碱性或中性稀溶液,在常温下,其c(H+)·c(OH-)=1×10-14
B.c(H+)等于1×10-7 mol/L的溶液一定是中性溶液
C.0.2 mol/L CH3COOH溶液中的c(H+)是0.1 mol/L CH3COOH溶液中的c(H+)的2倍
D.任何浓度的溶液都可以用pH来表示其酸碱性的强弱。
解析:选A A项,KW=c(H+)·c(OH-),且KW只与温度有关,所以,在常温下,纯水、酸性、碱性或中性稀溶液,均有KW=1×10-14;B项,在温度不确定时,中性溶液里的c(H+)不一定等于1×10-7 mol/L;C项,0.2 mol/L CH3COOH溶液中的CH3COOH电离程度比0.1 mol/L CH3COOH溶液中的CH3COOH电离程度小,所以,0.2 mol/L CH3COOH溶液中的c(H+)小于0.1 mol/L CH3COOH溶液中的c(H+)的2倍;D项,当c(H+)或c(OH-)大于1 mol/L时,用pH表示溶液的酸碱性就不简便了,所以,当c(H+)或c(OH-)大于1 mol/L时,一般不用pH表示溶液的酸碱性,而是直接用c(H+)或c(OH-)来表示。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
某工厂提取粗盐后的盐卤(主要成分为MgCl2)制备金属镁,其工艺流程图如下所示,下列说法错误的是:
盐卤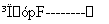 Mg(OH)2
Mg(OH)2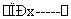 MgCl2溶液
MgCl2溶液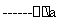 MgCl2•.6H2O
MgCl2•.6H2O 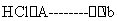 MgCl2
MgCl2 Mg
Mg
A.若在实验室进行操作①,只需要漏斗和烧杯两种玻璃仪器
B.操作①发生的反应为非氧化还原反应
C.操作②是蒸发浓缩结晶
D.在整个制备过程中,未发生置换反应
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法错误的是( )
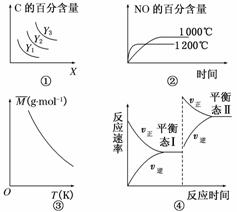
A.对于A(s)+2B(g)3C(g) ΔH>0,若平衡时C的百分含量跟条件X、Y的关系如图①所示,则Y可能表示温度,X可能表示压强,且Y1>Y2>Y3
B.已知可逆反应4NH3(g)+5O2(g)4NO(g)+6H2O(g) ΔH=-1 025 kJ·mol-1。若反应物起始物质的量相同,则图②可表示温度对NO的百分含量的影响
C.已知反应2A(g)B(?)+2C(?)-Q(Q>0),满足如图③所示的关系,则B、C可能 均为气体
D.图④是恒温下某化学反应的反应速率随反应时间变化的示意图,则该反应的正反应是一个气体体积增大的反应
查看答案和解析>>
科目:高中化学 来源: 题型:
室温下,对于0.10 mol·L-1的 氨水,下列判断正确的是( )
氨水,下列判断正确的是( )
A.与AlCl3溶液发生反应的离子方程式为Al3++3OH-===Al(OH)3↓
B.加水稀释后,溶液中c(NH )·c(OH-)变大
)·c(OH-)变大
C.用HNO3溶液完全中和后,溶液不显中性
D.其溶液的pH=13
查看答案和解析>>
科目:高中化学 来源: 题型:
室温下,用0.100 mol/L NaOH 溶液分别滴定20.00 mL 0.100 mol/L的盐酸和醋酸,滴定曲线如下图所示。下列说法正确的是( )
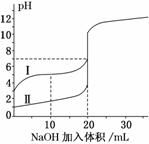
A.Ⅰ、Ⅱ分别表示盐酸和醋酸的滴定曲线
B.V(NaOH)=10.00 mL 时,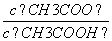 >1
>1
C.pH=7时,两种酸所用NaOH溶液的体积相等
D.V(NaOH)=20 .00 mL 时,c(Cl-)<c(CH3COO-)
查看答案和解析>>
科目:高中化学 来源: 题型:
下列溶液中微粒浓度关系一定正确的是( )
A.常温下,氨水与氯化铵的pH=7的混合溶液中:c(Cl-)=c(NH )
)
B.pH=1的一元酸和pH=13的一元碱等体积混合:c(OH-)=c(H+)
C.0.1 mol·L-1的硫酸铵溶液中:c(NH )>c(SO
)>c(SO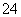 )>c(H+)>c(OH-)
)>c(H+)>c(OH-)
D.0.1 mol·L-1的硫化钠溶液中:c(OH-)=c(H+)+c(HS-)+c(H2S)
查看答案和解析>>
科目:高中化学 来源: 题型:
弱电解质的电离平衡、盐类的水解平衡和难溶物的溶解平衡均属于化学平衡。
Ⅰ.已知H2A在水中存在以下平衡:H2A===H++HA-,HA-H++A2-。
(1)常温下NaHA溶液的pH________(填序号),原因是_________________。
A.大于7 B.小于7
C.等于7 D.无法确定
(2)某温度下,若向0.1 mol·L-1的NaHA溶液中逐滴滴加0.1 mol·L-1KOH溶液至溶液呈中性(忽略混合后溶液的体积变化)。此时该混合溶液中的下列关系一定正确的是________。
A.c(H+)·c(OH-)=1.0×10-14
B.c(Na+)+c(K+)=c(HA-)+2c(A2-)
C.c(Na+)>c(K+)
D.c(Na+)+c(K+)=0.05 mol·L-1
(3)已知常温下H2A的钙盐(CaA)的饱和溶液中存在以下平衡:CaA(s)Ca2+(aq)+A2-(aq) ΔH>0。若要使该溶液中Ca2+浓度变小,可采取的措施有________。
A.升高温度 B.降低温度
C.加入NH4Cl晶体 D.加入Na2A固体
Ⅱ.含有Cr2O 的废水毒性较大,某工厂废水中含5.0×10-3 mol·L-1的Cr2O
的废水毒性较大,某工厂废水中含5.0×10-3 mol·L-1的Cr2O 。为了使废水的排放达标,进行如下处理:
。为了使废水的排放达标,进行如下处理:
Cr2O
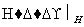 Cr3+、Fe3+
Cr3+、Fe3+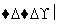 Cr(OH3)、Fe(OH)3
Cr(OH3)、Fe(OH)3
(1)该废水中加入绿矾和H+,发生反应的离子方程式为____________________。
(2)若处理后的废水中残留的c(Fe3+) =2.0×10-13 mol·L-1,则残留的Cr3+的浓度为________。
=2.0×10-13 mol·L-1,则残留的Cr3+的浓度为________。
(已知:Ksp[Fe(OH)3]=4.0×10-38,Ksp[Cr(OH)3]=6.0×10-31)
查看答案和解析>>
科目:高中化学 来源: 题型:
某气态有机物X含C、H、O三种元素,已知下列条件,现欲确定X的分子式,所需的最少条件是
( )
①X中含碳质量分数 ②X中含氢质量分数 ③X在标准状况下的体积 ④质谱确定X的相对分子质量 ⑤X的质量
A.①② B.①②④ C.①②⑤ D.③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验操作不能达到预期目的的是 ( )
| 实验目的 | 操作 | |
| A | 欲比较水和乙醇中羟基氢的活泼性 | 用金属钠分别与水和乙醇反应 |
| B | 欲证明CH2=CHCHO中含有碳碳双键 | 滴加酸性KMnO4溶液,看紫红色是否褪去 |
| C | 欲确定磷、砷两元素非金属性的强弱 | 测定同温同浓度的Na3PO4和Na3AsO4水溶液的pH |
| D | 欲除去苯中混有的苯酚 | 向混合液中加入NaOH溶液,充分反应后,分液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com