
| A. | 标准状况下,NA个SO3的体积为22.4 L | |
| B. | 1 mol Fe与足量的HCl溶液反应,转移的电子数为3NA | |
| C. | 2 L 1 mol•L-1的H3PO4溶液中所含的H+数为6NA | |
| D. | 标准状况下22.4 L Cl2通入足量的石灰乳制备漂白粉,转移电子数为NA |
分析 A、标况下三氧化硫为固体;
B、铁和盐酸反应后变为+2价;
C、磷酸为多元中强酸;
D、求出氯气的物质的量,然后根据氯气和碱的反应为歧化反应来分析.
解答 解:A、标况下三氧化硫为固体,故不能根据气体摩尔体积来计算其体积,故A错误;
B、铁和盐酸反应后变为+2价,故1mol铁反应后转移2NA个电子,故B错误;
C、磷酸为多元中强酸,不能完全电离,故溶液中的氢离子的个数小于6NA个,故C错误;
D、标况下22.4L氯气的物质的量为1mol,而氯气和碱的反应为歧化反应,故1mol氯气转移NA个电子,故D正确.
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,难度不大,应注意掌握公式的运用和物质的结构.


 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案 蓝天教育暑假优化学习系列答案
蓝天教育暑假优化学习系列答案科目:高中化学 来源: 题型:选择题
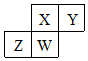 短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中W原子的质子数是其最外层电子数的三倍,下列说法正确的是( )
短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中W原子的质子数是其最外层电子数的三倍,下列说法正确的是( )| A. | 原子半径:Z>W>X>Y | |
| B. | 元素X、Y、Z、W的最高化合价分别与其主族序数相等 | |
| C. | 最简单气态氢化物的热稳定性:X>Z>W | |
| D. | 最高价氧化物对应水化物的酸性:X>Z>W |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
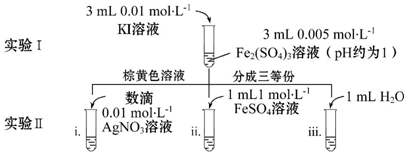
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 滴定管装滴定液时不应先用滴定液润洗 | |
| B. | 锥形瓶用作反应容器时一定不能加热 | |
| C. | 蒸馏时温度计水银球可以高于蒸馏瓶支管口 | |
| D. | 振荡分液漏斗时应关闭其玻璃塞和活塞 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验 | 实验内容 | 实验目的 |
| A | 将木炭与浓硫酸共热,得到的气体通入澄清石灰水 | 检验木炭的氧化产物是CO2 |
| B | 将1moLCuSO4•5H2O溶解在1L 水中 | 配制1moL/L的CuSO4溶液 |
| C | 加入适量CuO,充分反应后,过滤 | 除去CuCl2溶液中少量的FeCl3 |
| D | 饱和氯化铁溶液中滴加氨水 | 制备Fe(OH)3胶体 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | FeCl2溶液跟Cl2反应:2Fe2++Cl2═2Fe3++2Cl- | |
| B. | AlCl3溶液中加入足量的氨水:Al3++3OH-═Al(OH)3↓ | |
| C. | 三氯化铁溶液中加入铁粉:Fe3++Fe═2Fe3+ | |
| D. | 铝粉投入到NaOH溶液中:2Al+2OH-═2AlO2-+H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该材料耐高温、易导热、耐酸碱性强 | |
| B. | 该材料的主要成分也可用于制作太阳能电池板 | |
| C. | 网络通讯所用的光导纤维与该材料具有相同的化学成分 | |
| D. | 该光子晶体是平面网状结构,每隔Si与2个O成键,每个O与2个Si成键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
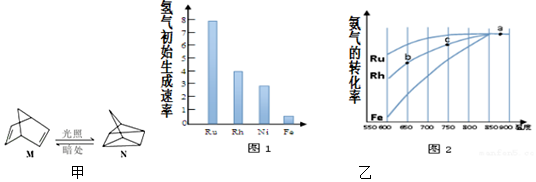
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com