
分析 Q、R、X、Y、Z五种元素的原子序数依次递增,Z的原子序数为29,为Cu元素,其余的均为短周期主族元素;Q、X原子p轨道的电子数分别为2和4,Q原子的核外电子排布为1s22s22p2,故Q为C元素,X原子的核外电子排布为1s22s22p4,则X为O元素,Y原子价电子(外围电子)排布msnmpn,则n=2,故为第ⅣA族元素,原子序数大于O元素,小于Cu元素,故Y为Si元素,R原子核外L层电子数为奇数,R原子有2个电子层,原子序数介于C元素与O元素之间,故R为N元素,据此解答.
解答 解:Q、R、X、Y、Z五种元素的原子序数依次递增,Z的原子序数为29,为Cu元素,其余的均为短周期主族元素;Q、X原子p轨道的电子数分别为2和4,Q原子的核外电子排布为1s22s22p2,故Q为C元素,X原子的核外电子排布为1s22s22p4,则X为O元素,Y原子价电子(外围电子)排布msnmpn,则n=2,故为第ⅣA族元素,原子序数大于O元素,小于Cu元素,故Y为Si元素,R原子核外L层电子数为奇数,R原子有2个电子层,原子序数介于C元素与O元素之间,故R为N元素.
(1)Cu原子的核外电子排布式是1s22s22p63s23p63d104s1,外围电子排布式为:3d104s1,
故答案为:3d104s1;
(2)硫酸铜溶液中滴加氨水会生成蓝色沉淀,在滴加氨水到沉淀刚好全部溶解可得到深蓝色溶液,由于Cu2+可以提供空轨道,NH3可提供孤对电子,形成配离子[Cu(NH3)4]2+,离子方程式为:Cu(OH)2+4NH3•H2O=[Cu(NH3)4]2++2OH-+4H2O 或Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH-,
故答案为:[Cu(NH3)4]2+;Cu(OH)2+4NH3•H2O=[Cu(NH3)4]2++2OH-+4H2O 或Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH-;
(3)Q形成的最简单气态氢化物甲为CH4,Y形成的最简单气态氢化物乙为SiH4,
ab.非金属性C>Si,故稳定性CH4>SiH4,二者结构相似,都可以形成分子晶体,相对分子质量越大,沸点越高,故沸点CH4<SiH4,故a错误、b正确;
c.Q、Y分别与X所形成的晶体分别为CO2(或CO)、SiO2,前者属于分子晶体,后者属于原子晶体,故c错误;
d.甲为CH4,由极性键构成,为正四面体对称结构,属于非极性分子,难溶于水,故d错误,
故答案为:b;
(4)同周期自左而右第一电离能增大趋势,氮元素2p能级容纳3个电子,为半满稳定状态,能量较低,第一电离能高于同周期相邻元素的,故第一电离能C<O<N,
故答案为:C<O<N.
点评 本题考查结构性质位置关系应用、核外电子排布规律、元素周期律、配合物、电离能等,推断元素是解题的关键,注意同周期元素第一电离能异常情况.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 6种 | B. | 5种 | C. | 4种 | D. | 3种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.5mol | B. | 1.0mol | C. | 1.5mol | D. | 2.0mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
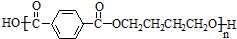
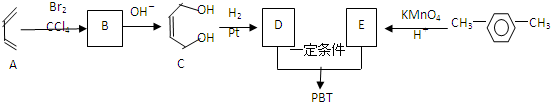
 互为同系物关系.
互为同系物关系.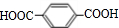 $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$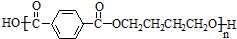 +(2n-1)H2O.
+(2n-1)H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 萃取是常用的有机物提纯方法 | |
| B. | 燃烧法是研究确定有机物成分的有效方法之一 | |
| C. | 对有机物分子红外光谱图的研究有助于确定有机物分子中的官能团 | |
| D. | 核磁共振氢谱通常用于分析有机物的相对分子质量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
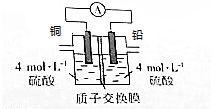 铅是一种活泼金属,铅与稀硫酸发生的反应为Pb+H2SO4(aq)═PbSO4(s)+H2↑,某同学根据反应设计如下装置:回答下列问题:
铅是一种活泼金属,铅与稀硫酸发生的反应为Pb+H2SO4(aq)═PbSO4(s)+H2↑,某同学根据反应设计如下装置:回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 Q、R、X、Y、Z是原子序数依次增大的前四周期元素,Q的一种单质是天然存在的最硬的物质,X原子的核外电子有八种运动状态,Y元素的离子半径是第三周期中最小的,Z是第四周期中未成对电子最多的原子.
Q、R、X、Y、Z是原子序数依次增大的前四周期元素,Q的一种单质是天然存在的最硬的物质,X原子的核外电子有八种运动状态,Y元素的离子半径是第三周期中最小的,Z是第四周期中未成对电子最多的原子.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验序号 | a | b | c |
| 合金质量/mg | 510 | 765 | 918 |
| 气体体积/mL | 560 | 672 | 672 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氟酸保存在玻璃瓶中 | B. | 金属钠保存在煤油中 | ||
| C. | 氧化钠保存在敞口容器中 | D. | 浓硫酸保存在橡胶塞试剂瓶中 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com