
����Ŀ���ù���Ч�Ķ������ȣ�ClO2�����Һ�Ƚ����������ɱ�����������彡���к����л��ȴ��
��1���������ȣ�ClO2����Ŀǰ�����Ϲ��ϵĵ��Ĵ���Ч�����Ĺ�����������������KClO3��H2SO4��������Na2SO3��Ӧ�Ƶã���д����Ӧ�����ӷ���ʽ�� ��
��2��Ư���������ƣ�NaClO2���ڳ��ºڰ����ɱ���һ�꣬������ȶ��ɷֽ⣬��Ӧ�����ӷ���ʽΪ��HClO2��ClO2��+H++Cl��+H2O��δ��ƽ������1molHClO2�����ֽⷴӦʱ��ת�Ƶĵ��Ӹ����� ��
��3����Ч�Ⱥ����Ǻ�����������һ����Ҫָ�꣬��Ч�Ⱥ����Ķ���Ϊ����HI����������ͬ����I2����Cl2��������ָ������������������֮�ȣ����ðٷ�����ʾ����ClO2����Ч�Ⱥ����� ��
���𰸡�
��1��2ClO3��+SO32��+2H++SO42���T2ClO2��+2SO42��+H2O
��2��0.8NA
��3��263%
���������⣺��1������Ϣ��֪��KClO3��H2SO4��������Na2SO3����������ԭ��Ӧ����Ӧ���ɶ������ȣ������ƺ�ˮ��������Ӧ�Ļ�ѧ����ʽΪ��2NaClO3+Na2SO3+H2SO4�T2ClO2��+2Na2SO4+H2O�����ӷ���ʽΪ��2ClO3��+SO32��+2H++SO42���T2ClO2��+2SO42��+H2O�����Դ��ǣ�2ClO3��+SO32��+2H++SO42���T2ClO2��+2SO42��+H2O����2����HClO2��ClO2��+H++Cl��+H2O��֪����Ӧ����ClԪ�صĻ��ϼۼ������ֽ��ͣ���ƽ�õ����ӷ���ʽΪ��5HClO2=4ClO2��+H++Cl��+2H2O����Ӧ��ÿ5molHClO2�ֽ����ת�������ʵ���Ϊ4mol������1molHClO2�ֽ�ʱ��ת�Ƶĵ�����Ϊ ![]() ��NAmol��1=0.8NA �� ���Դ��ǣ�0.8NA����3����Cl2+2HI=I2+2HCl��2ClO2+10HI=2HCl+5I2+4H2O��֪��������5molI2ʱ��Ҫ�������������ȵ����ʵ�����Ϊ5��2������ClO2����Ч�Ⱥ���Ϊ
��NAmol��1=0.8NA �� ���Դ��ǣ�0.8NA����3����Cl2+2HI=I2+2HCl��2ClO2+10HI=2HCl+5I2+4H2O��֪��������5molI2ʱ��Ҫ�������������ȵ����ʵ�����Ϊ5��2������ClO2����Ч�Ⱥ���Ϊ ![]() ��100%=263%�����Դ��ǣ�263%��
��100%=263%�����Դ��ǣ�263%��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ������Ҫ0.1molL��1 NaOH��Һ450mL���ش��������⣺ 
��1����ͼ��ʾ��������������Һ�϶�����Ҫ����������ţ�������������Һ�����õ��IJ��������������������ƣ���
��2��������NaOH��Һʱ��
�ٸ��ݼ�����������ƽ��ȡNaOH������Ϊg��
����NaOH��Һ��ת��������ƿʱ����������������������ҺŨ��0.1mol/L�����������������=������
����NaOH�����ܽ��������������ƿ��ϴ�ձ���ϴ��Һ��������ƿ�����ݣ���������ҺŨ��0.1molL��1�����������������=������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������H+ + OH�� = H2O ����ʾ�Ļ�ѧ��Ӧ�ǣ�
A. Ba(OH)2��Һ��HNO3��Һ��Ӧ
B. NH3��H2O����ϡH2SO4
C. KOH��Һ��CH3COOH��Һ��Ӧ
D. Ba(OH)2 ��Һ��H2SO4��Һ��Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҡҡ������һ�ּ��ü�������ϡ���ʳʱ�����Ϲ�����еĻ�ѧ���ʺ�ˮ��Ϻ�ҡ���������䡣�û�ѧ���ʿ�����
A���Ȼ��� B����������� C����ʯ�� D������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ڷ�Ӧ��4NH3��g��+5O2��g��4NO��g��+6H2O��g��������Ϊ���ֲ�ͬ����²�õķ�Ӧ���ʣ������ܱ����÷�Ӧ���������ǣ� ��
A.v��NH3��=0.2molL��1s��1
B.v��O2 ��=0.24 molL��1s��1
C.v��H2O��=0.25 molL��1s��1
D.v��NO��=0.15 molL��1s��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ǧ�����ǵ��͵Ŀɳ���أ������������Ƕ��Բ��ϣ�����ܷ�ӦʽΪ��
Pb��PbO2��4H����2SO![]()
![]() 2PbSO4��2H2O
2PbSO4��2H2O
��ش���������(�������⡢����������ԭ)��
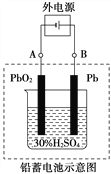
(1)�ŵ�ʱ�������ĵ缫��Ӧʽ��_______________________________��
���Һ��H2SO4��Ũ�Ƚ���__________�������·ͨ��1 mol����ʱ�������ϸ��������������__________����������ĵ��������ʵ���Ϊ__________��
(2)����ȫ�ŵ�ľ�PbO2��Pbʱ��������ͼ���ӣ����һ��ʱ�������A�缫������______��B�缫������_______����ʱǦ���ص���������ԭǦ���ص�������_______����������ͬ�������෴����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1����MnSO4������Ļ����Һ�����K2S2O8(���������)����Һ�лᷢ�����·�Ӧ��Mn2++ S2O82-+H2O��MnO4-+SO42һʮH+�÷�Ӧ�����ڼ���Mn2+�Ĵ��ڡ�������������_____________������Ӧ����0��1 mol��ԭ���μӷ�Ӧ�������������������ʵ���Ϊ____________mol��
��2�����÷�Ӧ���õ������̸�Ϊ�Ȼ��̣������������Ĺ�������ط�Ӧʱ�����и�����ء�����ء����������⣬�����������ﻹ��___________________��
��3����NaBiO3����(��ɫ��)���뵽MnSO4��H2SO4�Ļ����Һ����ȣ������ܽ��Ϊ������Һ���������·�Ӧ��
___NaBiO3+ MnSO4+ H2S04�� Na2S04+ Bi2(SO4)3+ NaMnO4+ H2O��
����ƽ������Ӧ�Ļ�ѧ����ʽ��
��������Ӧ�л�ԭ������_______________��
���õ����ű�ʾ��������ԭ��Ӧת�Ƶ������:_______________________________________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����
A. ������������ͬ�Ĺ�����
B. �����������γ�ˮ����ζ����Ҫ�ɷ�
C. ����Ũ��ˮ�ڴ��������·�Ӧ�����屽
D. �����ʵ�ˮ����ﶼ�����Ȼ����ǻ�
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com