
| A.①②③④ | B.②④⑥ | C.①③⑤ | D.②④⑤ |


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源:不详 题型:单选题
| A.a、c两种元素只能组成化学式为ca3的化合物 |
| B.b、c、d分别与a形成的化合物,沸点由高到低依次为:d>c>b |
| C.原子半径由大到小的顺序是 e>f>b>c>a |
| D.元素的非金属性由强到弱的顺序是 d>c>f>b |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
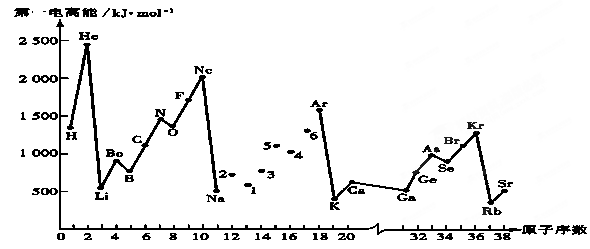
| A.3.5 | B.1.8 | C.2.5 | D.4.0 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 元素编号 | 元素性质或原子结构 |
| R | 基态原子的最外层有3个未成对电子,次外层有2个电子 |
| S | 单质能与水剧烈反应,所得溶液呈弱酸性 |
| T | 基态原子3d轨道上有1个电子 |
| X | 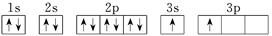 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.通常用小黑点来表示电子的多少,黑点密度大,电子数目大 |
| B.黑点密度大,单位体积内电子出现的机会大 |
| C.通常用小黑点来表示电子绕核作高速圆周运动 |
| D.电子云图是对电子运动无规律性的描述 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| A.作调味剂 | B.用于食物防腐 | C.用于氯碱工业 | D.用于医疗 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.还原性:X的氢化物>Y的氢化物>Z的氢化物 |
| B.简单离子的半径:M的离子>Z的离子>Y的离子>X的离子 |
| C.YX2、M2Y都含有极性共价键 |
| D.Z元素的最高价氧化物的水化物的化学式为HZO4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com