

| Ąė×Ó | æŖŹ¼³ĮµķŹ±µÄpH | ĶźČ«³ĮµķŹ±µÄpH |
| Fe3+ | 2.7 | 3.7 |
| Y3+ | 6.0 | 8.2 |
·ÖĪö īĘæóŹÆ£ØY2FeBe2Si2O10£©£¬¼ÓČėĒāŃõ»ÆÄĘ¹²ČŪŗóĖ®ČܹżĀĖµĆµ½¹čĖįÄĘ”¢īėĖįÄĘČÜŅŗ£¬³ĮµķĪŖY£ØOH£©3ŗĶFe2O3£¬¼ÓČėĻ”ŃĪĖįČܽāŗó¼ÓČė°±Ė®µ÷½ŚČÜŅŗPHŌŚ3.7£¼a£¼6.0·¶Ī§³ĮµķĢśĄė×Ó£¬¼ĢŠų¼ÓČė°±Ė®µ÷½ŚČÜŅŗPHŌŚ8.2ŅŌÉĻ¼ÓČė²ŻĖį³ĮµķµĆµ½²ŻĖįīĘ£¬¹żĀĖĖ®Ļ“ģŃÉÕµĆµ½Y2O3£¬
£Ø1£©īĘæóŹÆÓėĒāŃõ»ÆÄĘ¹²ČŪŹ±·“Ӧɜ³É¹čĖįÄĘ”¢īėĖįÄĘČÜŅŗ£¬³ĮµķĪŖY£ØOH£©3ŗĶFe2O3£¬½įŗĻŌ×ÓŹŲŗćÅäĘ½ŹéŠ“£»
£Ø2£©¢ŁÖÜĘŚ±ķÖŠ£¬īė”¢ĀĮŌŖĖŲ“¦ÓŚµŚ¶žÖÜĘŚŗĶµŚČżÖÜĘŚµÄ¶Ō½ĒĻßĪ»ÖĆ£¬»ÆѧŠŌÖŹĻąĖĘ£¬Óū“ÓNa2SiO3ŗĶNa2BeO2µÄ»ģŗĻČÜŅŗÖŠÖʵĆBe£ØOH£©2³Įµķ£¬ĖłŅŌNa2BeO2µÄŠŌÖŹŗĶNaAlO2Ąą±ČĶʶĻ£»¼Ó¹żĮæµÄŃĪĖį£¬¹čĖįÄĘ·“Ӧɜ³É¹čĖį³Įµķ£¬Na2BeO2µÄ·“Ӧɜ³ÉĀČ»ÆīėČÜŅŗ£¬ŌŁ¼ÓČė¹żĮæ°±Ė®³ĮµķīėĄė×Ó£»
¢ŚNa2BeO2Óė×ćĮæŃĪĖį·“Ӧɜ³ÉĀČ»ÆīėŗĶĀČ»ÆÄĘČÜŅŗ£»
£Ø3£©·“Ó¦Fe3++3H2O?Fe£ØOH£©3+3H+£¬Ę½ŗā³£ŹżK=$\frac{{c}^{3}£Ø{H}^{+}£©}{c£ØF{e}^{3+}£©}$£¬c£ØH+£©=10-2.7mol/L£¬Ė®½ā·“Ó¦ŠĪ³ÉµÄŹĒĒāŃõ»ÆĢś±„ŗĶČÜŅŗ£¬c£ØFe3+£©=10-5mol/L£»ĢśĄė×ÓÓöµ½KSCNČÜŅŗŠĪ³ÉŗģÉ«ČÜŅŗ£»
£Ø4£©¢ŁĒāŃõ»ÆīĘŗĶ²ŻĖį·“Ӧɜ³É²ŻĖįīĘŗĶĖ®£»
¢ŚČōH2C2O4ŗĶŹŖČóµÄKClO3»ģŗĻ¼ÓČȵ½60”ęæÉÖĘµĆ¹ś¼Ź¹«ČĻµÄøߊ§ŗ¬ĀČĻū¶¾¼ĮClO2£¬ŅĄ¾Ż·“Ó¦¶ØĮæ¹ŲĻµ¼ĘĖćŃõ»Æ¼ĮŗĶŃõ»Æ²śĪļµÄĪļÖŹµÄĮæÖ®±Č£»ŌŚČČĖ®ÖŠClO2»į·¢Éś·“Ӧɜ³ÉCl2ŗĶHClO2£¬Ńõ»Æ»¹Ō·“Ó¦µē×ÓŹŲŗćÅŠ¶Ļ²śĪļÖŠ»¹Éś³ÉŃõĘų£®
½ā“š ½ā£ŗīĘæóŹÆ£ØY2FeBe2Si2O10£©£¬¼ÓČėĒāŃõ»ÆÄĘ¹²ČŪŗóĖ®ČܹżĀĖµĆµ½¹čĖįÄĘ”¢īėĖįÄĘČÜŅŗ£¬³ĮµķĪŖY£ØOH£©3ŗĶFe2O3£¬¼ÓČėĻ”ŃĪĖįČܽāŗó¼ÓČė°±Ė®µ÷½ŚČÜŅŗPHŌŚ3.7£¼a£¼6.0·¶Ī§³ĮµķĢśĄė×Ó£¬¼ĢŠų¼ÓČė°±Ė®µ÷½ŚČÜŅŗPHŌŚ8.2ŅŌÉĻ¼ÓČė²ŻĖį³ĮµķµĆµ½²ŻĖįīĘ£¬¹żĀĖĖ®Ļ“ģŃÉÕµĆµ½Y2O3£¬
£Ø1£©īĘæóŹÆÓėĒāŃõ»ÆÄĘ¹²ČŪŹ±·“Ӧɜ³É¹čĖįÄĘ”¢īėĖįÄĘČÜŅŗ£¬³ĮµķĪŖY£ØOH£©3ŗĶFe2O3£¬½įŗĻŌ×ÓŹŲŗćÅäĘ½ŹéŠ“µĆµ½»Æѧ·½³ĢŹ½ĪŖ£ŗ4Y2FeBe2Si2O10+32NaOH+O2=8Y£ØOH£©3+2Fe2O3+8Na2SiO3+8Na2BeO2+4H2O£¬
¹Ź“š°øĪŖ£ŗ4Y2FeBe2Si2O10+32NaOH+O2=8Y£ØOH£©3+2Fe2O3+8Na2SiO3+8Na2BeO2+4H2O£»
£Ø2£©¢ŁÖÜĘŚ±ķÖŠ£¬īė”¢ĀĮŌŖĖŲ“¦ÓŚµŚ¶žÖÜĘŚŗĶµŚČżÖÜĘŚµÄ¶Ō½ĒĻßĪ»ÖĆ£¬»ÆѧŠŌÖŹĻąĖĘ£¬Óū“ÓNa2SiO3ŗĶNa2BeO2µÄ»ģŗĻČÜŅŗÖŠÖʵĆBe£ØOH£©2³Įµķ£¬ĖłŅŌNa2BeO2µÄŠŌÖŹŗĶNaAlO2Ąą±ČĶʶĻ£»¼Ó¹żĮæµÄŃĪĖį£¬¹čĖįÄĘ·“Ӧɜ³É¹čĖį³Įµķ£¬Na2BeO2µÄ·“Ӧɜ³ÉĀČ»ÆīėČÜŅŗ£¬ŌŁ¼ÓČė¹żĮæ°±Ė®³ĮµķīėĄė×Ó£¬
¹Ź“š°øĪŖ£ŗb£»
¢ŚNa2BeO2Óė×ćĮæŃĪĖį·¢Éś·“Ӧɜ³ÉĀČ»ÆīėĀČ»ÆÄĘŗĶĖ®£¬·“Ó¦µÄĄė×Ó·½³ĢŹ½ĪŖ£ŗBeO22-+4H+=Be2++2H2O£¬
¹Ź“š°øĪŖ£ŗBeO22-+4H+=Be2++2H2O£»
£Ø3£©·“Ó¦Fe3++3H2O?Fe£ØOH£©3+3H+£¬Ę½ŗā³£ŹżK=$\frac{{c}^{3}£Ø{H}^{+}£©}{c£ØF{e}^{3+}£©}$£¬c£ØH+£©=10-2.7mol/L£¬Ė®½ā·“Ó¦ŠĪ³ÉµÄŹĒĒāŃõ»ÆĢś±„ŗĶČÜŅŗ£¬c£ØFe3+£©=10-5mol/L£¬ŌņĘ½ŗā³£ŹżK=$\frac{{c}^{3}£Ø{H}^{+}£©}{c£ØF{e}^{3+}£©}$=$\frac{£Ø1{0}^{-2.7}£©^{3}}{1{0}^{-5}}$=8”Į10-5£¬¼ģŃéFe3+ŹĒ·ń³ĮµķĶźČ«µÄ²Ł×÷ĪŖ£ŗȔɣĮæĀĖŅŗ£¬µĪ¼Ó¼øµĪKSCNČÜŅŗ£¬¹Ū²ģČÜŅŗŹĒ·ń±äĪŖŃŖŗģÉ«£¬Čō¹Ū²ģ²»µ½ŃŖŗģÉ«£¬ŌņĖµĆ÷Fe3+³ĮµķĶźČ«£¬
¹Ź“š°øĪŖ£ŗ8”Į10-5£»Č”ÉŁĮæĀĖŅŗ£¬µĪ¼Ó¼øµĪKSCNČÜŅŗ£¬¹Ū²ģČÜŅŗŹĒ·ń±äĪŖŃŖŗģÉ«£¬Čō¹Ū²ģ²»µ½ŃŖŗģÉ«£¬ŌņĖµĆ÷Fe3+³ĮµķĶźČ«£»
£Ø4£©¢ŁĒāŃõ»ÆīĘŗĶ²ŻĖį·“Ӧɜ³É²ŻĖįīĘŗĶĖ®£¬·“Ó¦µÄ»Æѧ·½³ĢŹ½ĪŖ£ŗ2 Y£ØOH£©2£Øs£©+2H2C2O4£Øaq£©=Y2£ØC2O4£©3£Øs£©+6H2O£Øl£©£¬
¹Ź“š°øĪŖ£ŗ2 Y£ØOH£©2£Øs£©+2H2C2O4£Øaq£©=Y2£ØC2O4£©3£Øs£©+6H2O£Øl£©£»
¢ŚČōH2C2O4ŗĶŹŖČóµÄKClO3»ģŗĻ¼ÓČȵ½60”ęæÉÖĘµĆ¹ś¼Ź¹«ČĻµÄøߊ§ŗ¬ĀČĻū¶¾¼ĮClO2£¬·“Ó¦µÄ»Æѧ·½³ĢŹ½ĪŖ£ŗH2C2O4+2KClO3=2ClO2”ü+CO2”ü+K2CO3+H2O£¬ĘäÖŠKClO3ĪŖŃõ»Æ¼Į£¬CO2ŗĶK2CO3ŹĒŃõ»Æ²śĪļ£¬ŌņŃõ»Æ¼ĮŗĶŃõ»Æ²śĪļĪļÖŹµÄĮæÖ®±ČĪŖ1£»1£¬ŌŚČČĖ®ÖŠ¶žŃõ»ÆĀČŗĶĖ®·“Ó¦µÄ»Æѧ·½³ĢŹ½ĪŖ£ŗ6ClO2+2H2O=Cl2+4HClO2+3O2£¬
¹Ź“š°øĪŖ£ŗ1£ŗ1£»6ClO2+2H2O=Cl2+4HClO2+3O2£®
µćĘĄ ±¾Ģāæ¼²éĮĖĪļÖŹ·ÖĄėĢį“æµÄ¹ż³Ģ·ÖĪö”¢ĪļÖŹŠŌÖŹŗĶ·“Ó¦ĻÖĻóµÄÅŠ¶Ļ”¢Ę½ŗā³£Źż¼ĘĖć”¢Ńõ»Æ»¹Ō·“Ó¦»Æѧ·½³ĢŹ½ŹéŠ“ŗĶµē×ÓŹŲŗćµÄ¼ĘĖćÓ¦ÓĆ£¬ÕĘĪÕ»ł“”ŹĒ½āĢā¹Ų¼ü£¬ĢāÄæÄѶČÖŠµČ£®



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ¶¼ŹĒ¹²¼Ū»ÆŗĻĪļ | B£® | ¶¼ŹĒĄė×Ó»ÆŗĻĪļ | C£® | ¶¼ŗ¬ÓŠ¹²¼Ū¼ü | D£® | »„ĪŖĶ¬ĖŲŅģŠĪĢå |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ĢśŗĻ½š | B£® | ĀĮŗĻ½š | C£® | ĶŗĻ½š | D£® | øÖ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ¶ąŃ”Ģā
| ĘšŹ¼ÅØ¶Č | ¼× | ŅŅ | ±ū |
| c£ØNO2£©/mol•L-1 | 0.10 | 0.20 | 0.20 |
| C£ØSO2£©/mol•L-1 | 0.10 | 0.10 | 0.20 |
| A£® | ČŻĘ÷¼×ÖŠµÄ·“Ó¦ŌŚĒ°2 minµÄĘ½¾łĖŁĀŹv£ØSO2£©=0.05 mol•L-1•min-1 | |
| B£® | “ļµ½Ę½ŗāŹ±£¬ČŻĘ÷±ūÖŠÕż·“Ó¦ĖŁĀŹÓėČŻĘ÷¼×ĻąµČ | |
| C£® | ĪĀ¶ČÉżÖĮ90”ę£¬ÉĻŹö·“Ó¦Ę½ŗā³£ŹżĪŖ1.56£¬Ōņ·“Ó¦µÄ”÷H£¾0 | |
| D£® | ČŻĘ÷ŅŅÖŠČōĘšŹ¼Ź±øijä0.10 mol•L-1 NO2ŗĶ0.20mol•L-1 SO2£¬“ļµ½Ę½ŗāŹ±c£ØNO£©ÓėŌĘ½ŗāĻąĶ¬ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
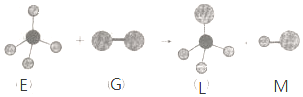
| A£® | ³£ĪĀ³£Ń¹ĻĀ£¬EŹĒŅ»ÖÖĪŽÉ«ĪŽĪ¶µÄĘųĢå | |
| B£® | øÉŌļµÄGÄÜĘÆ°×ÓŠÉ«ĪļÖŹ | |
| C£® | ŌŚ¹āÕÕĢõ¼žLÄÜÓė G¼ĢŠų·¢ÉśÓėÉĻŹöĄąĖʵķ“Ó¦ | |
| D£® | ÉĻŹö·“Ó¦ĄąŠĶŹĒČ”“ś·“Ó¦ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | CaCO3 | B£® | Al2O3 | C£® | Fe2O3 | D£® | MgO |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā

²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ±ź×¼×“æöĻĀ£¬1.12L ŗ¤ĘųĖłŗ¬Ō×ÓŹżĪŖ0.1NA | |
| B£® | 22.4 LHClČÜÓŚĖ®£¬ČÜŅŗÖŠH+ŹżĪŖNA | |
| C£® | 1.6gNH2-Ąė×ÓĖłŗ¬µē×ÓŹżĪŖNA | |
| D£® | 10g D2OĖłŗ¬µÄÖŠ×ÓŹżĪŖ4.5NA |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | AµÄ×Ŗ»ÆĀŹĪŖ¼×£¼±ū£¼ŅŅ£¼¶” | B£® | AµÄ×Ŗ»ÆĀŹĪŖ¼×£¼ŅŅ£¼¶”£¼±ū | ||
| C£® | BµÄ×Ŗ»ÆĀŹĪŖ¼×£¾ŅŅ£¾±ū£¾¶” | D£® | BµÄ×Ŗ»ÆĀŹĪŖ¼×£¼±ū£¼ŅŅ£¼¶” |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com