
| A. | 大多数化学反应在一定条件下都有一定的限度 | |
| B. | 当可逆反应达到反应限度时,反应会自动停止 | |
| C. | 使用催化剂,可降低反应的活化能,加快反应速率,改变反应限度 | |
| D. | FeCl3与KSCN反应达到平衡时,向其中加少量KCl固体,则溶液颜色变深 |
分析 A、化学反应最终都要进行到一定的限度;
B、当可逆反应达到反应限度时,即反应达到 平衡状态,平衡状态为动态平衡;
C、催化剂只能改变反应速率,不会引起化学平衡的移动;
D、根据实际参加反应的离子浓度分析,加入少量KCl固体,溶液中Fe3+、SCN-浓度不变.
解答 解:A、大多数化学反应在一定条件都有一定限度,最终达到化学平衡状态,故A正确;
B、可逆反应达到反应限度时,即反应达到 平衡状态,平衡状态为动态平衡,反应不会停止,故B错误;
C、用催化剂可降低反应活化能,同等程度加快正逆反应速率,但是不会改变反应限度,故C错误;
D、FeCl3溶液与KSCN溶液反应达到平衡时,加入少量KCl固体,溶液中Fe3+、SCN-浓度不变,K+和Cl-不参加反应,平衡不移动,溶液颜色无明显变化,故D错误.
故选:A.
点评 本题考查学生化学反应速率和化学平衡状态之间的关系等知识,属于综合知识的考查,难度不大.


科目:高中化学 来源:2016-2017学年湖北省高二上10月月考化学试卷(解析版) 题型:选择题
室温下,用0.1 mol·Lˉ 1 NaOH溶液分别滴定体积均为20mL、浓度均为0.1 mol·Lˉ1 HCl溶液和HX溶液,溶液的pH随加入NaOH溶液体积变化如图,下列说法不正确的是
1 NaOH溶液分别滴定体积均为20mL、浓度均为0.1 mol·Lˉ1 HCl溶液和HX溶液,溶液的pH随加入NaOH溶液体积变化如图,下列说法不正确的是
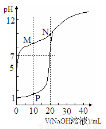
A.HX为弱酸
B.M点c(HX)-c(X-)﹥c(OH-)-c(H+)
C.将P点和N点的溶液混合,呈酸性
D.向N点的溶液中通入HCl至pH=7:c(Na+) ﹥c(HX) = c(Cl-) ﹥c(X-)
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南省高二上第一次月考化学卷(解析版) 题型:填空题
Ⅰ.按要求写出下列反应的热化学方程式:
(1)在25℃、101kPa下,1g甲醇液体燃烧生成C02和液态水时放热22.0kJ。则表示甲醇燃烧热的热化学方程式为__________________________。
(2)若适量的N2和02完全反应,每生成23g N02需要吸收16.0kJ热量,此反应的热化学方程式为___________________。
Ⅱ.对于下列三个反应,从正反开始进行达到平衡后,保持温度、体积 不变,按要求回答下列问题:
不变,按要求回答下列问题:
(1)PCl5(g) PCl3(g)+Cl2(g)
PCl3(g)+Cl2(g)
再充入PCl5(g),平衡向___________方向移动(填“正反应”或“逆反应”),达到平衡后,PCl5(g)的转化率___________(填“增大”、“减小”或“不变”,下同)。
(2)2HI(g) I2(g
I2(g )+H2(g)
)+H2(g)
再充入HI(g),平衡向___________方向移动,达到平衡后,HI的分解率___________。
(3)2NO2(g) N2O4(g)
N2O4(g)
再充入N2O4(g),平衡向___________方向移动,达到平衡后,NO2(g)的转化率___________。
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| t/℃ | 5 | 15 | 25 | 35 | 50 |
| K | 1100 | 841 | 680 | 533 | 409 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 甲烷作为一种新能源在化学领域应用广泛,请回答下列问题:
甲烷作为一种新能源在化学领域应用广泛,请回答下列问题:| 时间/min | 5 | 10 | 15 | 20 | 25 | 30 |
| c(NH3)/(mol/L) | 0.08 | 0.14 | 0.18 | 0.20 | 0.20 | 0.20 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 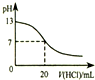 如图表示25℃时,用0.1 mol•L-1盐酸滴定20 mL 0.1 mol•L-1 NaOH溶液,溶液的pH随加入酸体积的变化 如图表示25℃时,用0.1 mol•L-1盐酸滴定20 mL 0.1 mol•L-1 NaOH溶液,溶液的pH随加入酸体积的变化 | |
| B. | 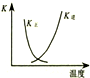 如图中曲线表示反应2SO2(g)+O2(g)?2SO3(g);△H<0 正、逆反应的平衡常数K随温度的变化 如图中曲线表示反应2SO2(g)+O2(g)?2SO3(g);△H<0 正、逆反应的平衡常数K随温度的变化 | |
| C. | 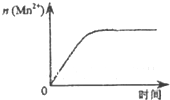 如图表示10 mL 0.0l mol•L-1KMnO4 酸性溶液与过量的0.1 mol•L-1H2C2O4 溶液混合时,n(Mn2+)随时间的变化 如图表示10 mL 0.0l mol•L-1KMnO4 酸性溶液与过量的0.1 mol•L-1H2C2O4 溶液混合时,n(Mn2+)随时间的变化 | |
| D. | 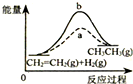 如图中a、b曲线分别表示反应CH2=CH2(g)+H2(g)→CH3CH3(g)+Q使用和未使用催化剂时,反应过程中的能量变化 如图中a、b曲线分别表示反应CH2=CH2(g)+H2(g)→CH3CH3(g)+Q使用和未使用催化剂时,反应过程中的能量变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 高容量的储氢材料研究是推广应用氢氧燃料电池的关键问题之一 | |
| B. | 大力发展新型电动汽车,可以减少燃油汽车的尾气排放量 | |
| C. | 生活中常用的蚕丝、棉花、淀粉、油脂等都是由高分子组成的物质 | |
| D. | 塑料袋在全球“失宠”,有偿使用成为风尚,是因为塑料袋填埋占用土地且难以降解 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含20.0g NaOH的稀溶液与稀盐酸完全中和,放出28.7kJ的热量,则稀醋酸和稀NaOH溶液反应的热化学方程式为: NaOH(aq)+CH3COOH(aq)═CH3COONa(aq)+H2O(l)△H=-57.4kJ•mol-1 | |
| B. | 已知C(石墨,s)═C(金刚石,s)△H>0,则石墨比金刚石稳定 | |
| C. | 已知反应2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ•mol-1,则H2的燃烧热为571.6kJ•mol-1 | |
| D. | 已知2C(s)+2O2(g)═2CO2(g)△H1;2C(s)+O2(g)=2CO(g)△H2,则△H1>△H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
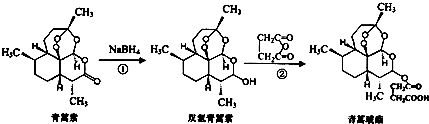
| A. | 青蒿素分子式为C15H22O5 | |
| B. | 青蒿素不能与NaOH溶液反应 | |
| C. | 反应②原子利用率为100% | |
| D. | 青蒿琥酯能与氢氧化钠溶液反应可生成青蒿琥酯钠 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com