
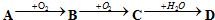
分析 (1)根据使湿润的红色石蕊试纸变蓝确定A是氨气,B为NO,C为NO2,进而确定D是硝酸;
(2)若A为活泼金属元素的单质,D为强碱,焰色反应显黄色,则A为Na、B为Na2O、C为Na2O2、D为NaOH,过氧化钠和水反应生成氢氧化钠和氧气;
(3)根据颜色确定A为S,根据一系列反应得出D为硫酸,即说明A是S,则B是二氧化硫,C是三氧化硫,D是硫酸,若将B 气体与H2S气体反应则会发现有淡黄色物质产生,是二氧化硫和硫化氢反应生成硫单质和水,检验某溶液中是否含有D中的阴离子是检验硫酸根离子的存在.
解答 解:(1)A的水溶液能使湿润的红色石蕊试纸变蓝,说明A是氨气,则B是一氧化氮,C是二氧化氮,D是硝酸.由氨气制得一氧化氮,是氨气的催化氧化,C为二氧化氮为红棕色气体,即4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O,
故答案为:NH3;红棕色,4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O;
(2)若A为活泼金属元素的单质,D为强碱,焰色反应显黄色,则A为Na、B为Na2O、C为Na2O2、D为NaOH,钠跟水发生反应的离子方程式为:2Na+2H2O═2Na++2OH-+H2↑,
故答案为:Na2O2;2Na2O2+2H2O═4NaOH+O2↑.
(3)常温下A为淡黄色固体单质,即说明A是S,则B是二氧化硫,C是三氧化硫,D是硫酸,若将B 气体与H2S气体反应则会发现有淡黄色物质产生,是二氧化硫和硫化氢反应生成硫单质和水,反应的化学方程式为:2H2S+SO2=3S+2H2O,检验某溶液中是否含有D中的阴离子是检验硫酸根离子的存在,可以取少量于试管中滴入盐酸无现象,加入氯化钡溶液生成白色沉淀证明含有硫酸根离子,
故答案为:S;SO2;2H2S+SO2=3S+2H2O;取少量于试管中滴入盐酸无现象,加入氯化钡溶液生成白色沉淀证明含有硫酸根离子;
点评 本题考查无机物推断,侧重于学生的分析能力的考查,需要学生熟练掌握元素化合物知识,注意掌握中学常见连续氧化反应,物质性质的熟练掌握是解题关键,题目较简单.


科目:高中化学 来源: 题型:解答题
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下SO3是液体 | |
| B. | 标准状况下,1 mol SO3的体积约为22.4L | |
| C. | SO3与CaO反应生成CaSO3 | |
| D. | SO2遇空气即生成SO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ③ | C. | ③④ | D. | ④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 某溶液$\stackrel{+AgNO_{3}溶液}{→}$生成白色沉淀,说明原溶液中含有Cl- | |
| B. | 某溶$\stackrel{+HCl溶液}{→}$无现象$\stackrel{+BaCl_{2}溶液}{→}$生成白色沉淀,+说明原溶液中含有SO42- | |
| C. | 某溶$\stackrel{+NaOH溶液}{→}$生成红褐色沉淀,说明原溶液中含有Fe3+ | |
| D. | 某溶$\stackrel{+稀硫酸}{→}$生成无色气体,说明原溶液中含有CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | B | C | D |
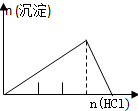
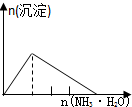
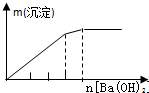
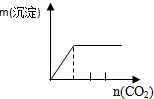
| NaAlO2溶液中逐滴滴加盐酸至过量 | AlCl3溶液中逐滴滴加氨水至过量 | 明矾[KAl(SO4)2•12H2O]溶液中逐滴滴加Ba(OH)2溶液至过量 | 澄清石灰水中缓慢通入CO2至过量 |
 |  |  |  |
| A. | A、 | B. | B、 | C. | C、 | D. | D、 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HNO3溶液 | B. | Ba(OH)2溶液 | C. | H2SO4溶液 | D. | HCl溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 不同时间各物质的物质的量/mol | ||||
| 0min | 2min | 4min | 6min | |
| CH4 | 2.00 | 1.76 | 1.60 | n2 |
| H2 | 0.00 | 0.72 | n1 | 1.20 |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com