
| A. | 由H+(aq)+OH- (aq)═H2O(l);△H=-57.3 kJ•mol-1:可知含1 mol氢氧化钡的溶液与含0.5 mol硫酸的稀溶液混合,放出热量大于57.3 kJ | |
| B. | 由H2O(g)═H2O(l)△H=-44.0kJ•mol-1可知是放热反应 | |
| C. | 由SO2(g)+0.5O2(g)═SO3(g)△H=-98.3 kJ•mol-1可知,在密闭容器中充入2 mol SO2和1 mol O2充分反应后,放出热量为196.6 kJ | |
| D. | 由△G=△H-T△S可知,所有放热反应都能自发进行 |
分析 A、稀硫酸与氢氧化钡溶液混合,不仅仅是酸碱中和,还会生成BaSO4;
B、物质三态之间的变化是物理变化,而反应热是化学变化;
C、SO2(g)+0.5O2(g)═SO3(g)△H=-98.3 kJ•mol-1是完全转化,而2 mol SO2和1 mol O2充分反应后,不可能完全转化;
D、反应自发进行由焓变、熵变、温度共同决定.
解答 解:A、硫酸根与钡离子反应生成硫酸钡沉淀也会放热,所以放出热量大于57.3 kJ,故A正确;
B、物质三态之间的变化是物理变化,而反应热是化学变化,故B错误;
C、SO2(g)+0.5O2(g)═SO3(g)△H=-98.3 kJ•mol-1是完全转化,而2 mol SO2和1 mol O2充分反应后,不可能完全转化,所以在密闭容器中充入2 mol SO2和1 mol O2充分反应后,放出热量小于196.6 kJ,故C错误;
D、反应自发进行由△G=△H-T△S<0确定,可知,放热反应△H<0,若高温下,△S<0,可能存在△G=△H-T△S>0,所以不是所有放热反应都能自发进行,故D错误;
故选A.
点评 本题考查了反应能量变化分析判断,中和热判断,反应自发进行的依据,可逆反应的应用,题目难度中等.


科目:高中化学 来源: 题型:解答题
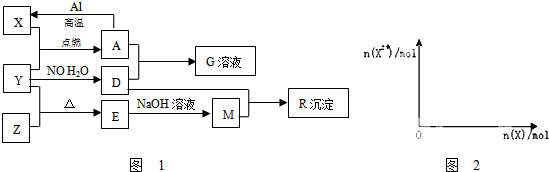
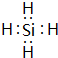 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
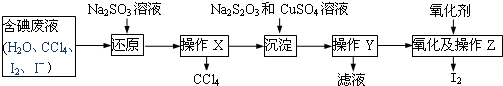
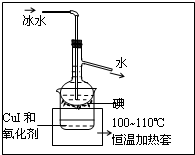
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
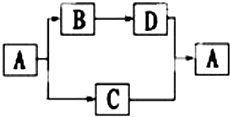 A、B、C、D都是初中化学中的常见物质,具有如图所示的转化关系(反应条件、有些反应物或产 物已略去):
A、B、C、D都是初中化学中的常见物质,具有如图所示的转化关系(反应条件、有些反应物或产 物已略去):查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| P-P | P-O | P=O | O=O | |
| 键能 (kJ/mol) | a | b | c | d |

| A. | (4c+12b-6a-5d)kJ•mol-1 | B. | (6a+5d-4c-12b)kJ•mol-1 | ||
| C. | (4c+12b-4a-5d)kJ•mol-1 | D. | (4a+5d-4c-12b)kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
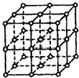 如图所示,直线交点处的圆圈为NaCl晶体中Na+离子或Cl-离子所处的位置.这两种离子在空间三个互相垂直的方向上都是等距离排列的.
如图所示,直线交点处的圆圈为NaCl晶体中Na+离子或Cl-离子所处的位置.这两种离子在空间三个互相垂直的方向上都是等距离排列的.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
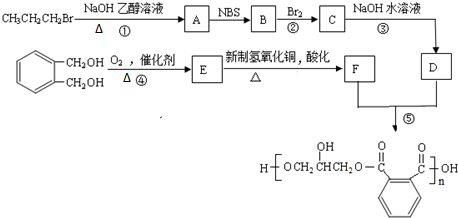

 .
. .
.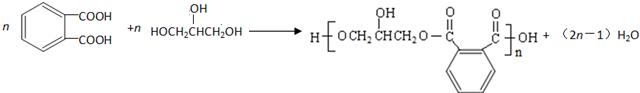 .
.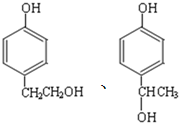 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com