

| SaSO4 | BaSO4 | Sr��OH��2 | |
| Ksp | 3.3��10-7 | 1.1��10-10 | 3.2��10-4 |
| Ksp(BaSO4) |
| c(Ba2+) |
| 1.1��10-10 |
| 1��10-5 |
| Ksp(SrSO4) |
| c(SO42-) |
| 3.3��10-7 |
| 1.1��10-5 |



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A����������Ԫ�ص�ԭ�Ӱ뾶��СΪX��Y��Z��W |
| B��������X2W2�д����������͵Ļ�ѧ�� |
| C����������������Ӧˮ����ļ���ǿ�����ԱȽ�X��Y�Ľ�����ǿ�� |
| D��W��Z���⻯��ķе㣺HmW��HmZ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��-183 kJ/mol |
| B��-91.5 kJ/mol |
| C��+183 kJ/mol |
| D��+91.5 kJ/mol |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A����ˮ | B��������Ũ���� |
| C������ | D������ѹǿ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A�������£�pH=2����ˮ�У�c��Cl-��+c��ClO-��+c��OH-��=0.01mol/L |
| B����˫��ˮ��ϡ���ᴦ��ӡˢ��·�壺Cu+H2O2+2H+�TCu2++2H2O |
| C��MgCO3���Գ�ȥMgCl2������Һ�е�Fe3+ |
| D����pH=1����Һ�У�NH4+��K+��ClO-��Cl-���Դ������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
2- 3 |
- 3 |
2- 3 |
- 3 |
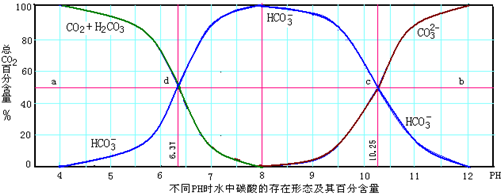
- 3 |
- 3 |
- 3 |
2- 3 |
2- 3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 ��֪������������ճ������м�Ϊ�������ᣬ��һ�������£�CH3COOH��Һ�д��ڵ���ƽ�⣺CH3COOH?CH3COO-+H+����H��0
��֪������������ճ������м�Ϊ�������ᣬ��һ�������£�CH3COOH��Һ�д��ڵ���ƽ�⣺CH3COOH?CH3COO-+H+����H��0| �ⶨ���� | ��һ�� | �ڶ��� | ������ | ���Ĵ� |
| V��mL�� | 19.40 | 15.10 | 14.90 | 15.00 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��Cu2++2OH-=Cu��OH��2�������� CuCO3+2NaOH=Cu��OH��2��+Na2CO3 |
| B��CO32-+2H+=CO2��+H2O����BaCO3+2HCl=BaCl2+CO2��+H2O |
| C��Ca2++CO32-=CaCO3�������� Ca��NO3��2+NaCO3=CaCO3��+NaNO3 |
| D��H++OH-=H2O������������ Ba��OH��2+2HNO3=Ba��NO3��2+2H2O |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com