
 随着大气污染的日趋严重,国家拟于“十二五”期间,将二氧化硫(SO2)排放量减少8%,氮氧化物(NOx)排放量减少10%.目前,消除大气污染有多种方法.
随着大气污染的日趋严重,国家拟于“十二五”期间,将二氧化硫(SO2)排放量减少8%,氮氧化物(NOx)排放量减少10%.目前,消除大气污染有多种方法.浓度/mol•L-1 时间/min | NO | N2 | CO2 |
| 0 | 1.00 | 0 | 0 |
| 10 | 0.58 | 0.21 | 0.21 |
| 20 | 0.40 | 0.30 | 0.30 |
| 30 | 0.40 | 0.30 | 0.30 |
| 40 | 0.32 | 0.34 | 0.17 |
| 50 | 0.32 | 0.34 | 0.17 |
分析 (1)已知:①CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H=-574kJ•mol-1
②CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ•mol-1
③H2O(g)═H2O(l)△H=-44.0kJ•mol-1
根据盖斯定律,(①+②+3×4)÷2可得:CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(g);
(2)SO2转化为SO42-该过程为氧气氧化二价铁离子到三价铁离子,然后用三价铁离子氧化二氧化硫到硫酸根离子;
(3)①根据v=$\frac{△c}{△t}$计算v(CO2)
②20min处于平衡状态,根据K=$\frac{c({N}_{2})×c(C{O}_{2})}{{c}^{2}(NO)}$计算平衡常数;
③一定温度下,随着NO的起始浓度增大,等效为增大压强,不影响平衡移动;
④可逆反应到达平衡时,同种物质的正逆速率相等,各组分的浓度、含量保持不变,由此衍生的其它一些量不变,判断平衡的物理量应随反应进行发生变化,该物理量由变化到不变化说明到达平衡;
⑤30min~40min之间,NO浓度减小0.08mol/L,N2浓度增大0.04mol/L,CO2浓度减小0.13mol/L,应是减小二氧化碳的浓度,瞬间减小二氧化碳的浓度为(0.3+0.04)mol/L-0.17mol/L=0.17mol/L,平衡时浓度为0.17mol/L.
解答 解:(1)已知:①CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H=-574kJ•mol-1
②CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ•mol-1
③H2O(g)═H2O(l)△H=-44.0kJ•mol-1
根据盖斯定律,(①+②+3×4)÷2可得:CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(g)△H=-955kJ•mol-1,
故答案为:CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(g)△H=-955kJ•mol-1;
(2)常温下将SO2转化为SO42-而实现SO2的处理.含SO2的废气通入含Fe2+、Fe3+的溶液时其中一个反应的离子方程式为:4Fe2++O2+4H+═4Fe3++2H2O,则另一反应的离子方程式为三价铁离子氧化二氧化硫到硫酸根离子,反应的离子方程式为:2Fe3++SO2+2H20=2Fe2++SO42-+4H+,
故答案为:2Fe3++SO2+2H2O=2Fe2++SO42-+4H+;
(3)①10min~20min以v(CO2) 表示的反应速率=$\frac{0.3mol/L-0.21mol/L}{20min-10min}$=0.009 mol•L-1•min-1,故答案为:0.009 mol•L-1•min-1;
②20min处于平衡状态,平衡常数K=$\frac{c({N}_{2})×c(C{O}_{2})}{{c}^{2}(NO)}$=$\frac{0.3×0.3}{0.{4}^{2}}$=0.56,
故答案为:0.56;
③一定温度下,随着NO的起始浓度增大,等效为增大压强,不影响平衡移动,则NO的平衡转化率不变,
故答案为:不变;
④A.反应是气体体积不变的反应,反应过程中容器内压强数值保持不变,故A错误;
B.当v正(NO)=2v逆(N2)反应达到平衡,故B错误;
C.容器内CO2的体积分数不变,说明反应达到平衡,故C正确;
D.混合气体密度等于质量除以体积,反应中碳是固体,平衡移动气体质量变化,体积不变,随反应进行混合气体密度增大,混合气体的密度保持不变说明反应达到平衡,故D正确;
故选:CD;
⑤30min~40min之间,NO浓度减小0.08mol/L,N2浓度增大0.04mol/L,CO2浓度减小0.13mol/L,应是减小二氧化碳的浓度,瞬间减小二氧化碳的浓度为(0.3+0.04)mol/L-0.17mol/L=0.17mol/L,该瞬间二氧化碳浓度为0.13mol/L,平衡时浓度为0.17mol/L,则30min至40minCO2浓度的变化曲线图象为,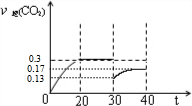 ,故答案为:减小CO2 的浓度;
,故答案为:减小CO2 的浓度; .
.
点评 本题考查化学平衡计算与影响因素、平衡状态判断、平衡常数、反应速率、热化学方程式书写等,(3)中作图为易错点,注意二氧化碳的瞬间浓度与平衡浓度.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | 熔点/℃ | 沸点/℃ |
| PCl3 | -112 | 75.5 |
| POCl3 | 2 | 105.3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 浓度为0.06mol/L.
浓度为0.06mol/L.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
| 容器 | 甲 | 乙 | 丙 | |
| 反应物投入量 | 1molCO、2molH2 | 1molCH3OH | 2molCH3OH | |
| 平 衡 时 数 据 | CH3OH的浓度(mol/L) | c1 | c2 | c3 |
| 反应的能量变化 | a kJ | b kJ | c kJ | |
| 体系压强(Pa) | p1 | p2 | p3 | |
| 反应物转化率 | α1 | α2 | α3 | |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH3具有还原性 | B. | H-是很强的还原剂 | ||
| C. | H2是氧化产物,NH2$_2^-$是还原产物 | D. | 该反应属于置换反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com