
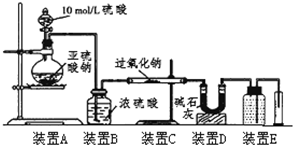
 某校化学兴趣小组在学习了过氧化钠性质后,进一步研究其与SO2反应情况,查阅相关资料知:过氧化钠与CO2反应有气体生成,而将SO2通入过氧化钠粉末中也有气体生成.有同学认为:CO2、SO2虽然都是酸性氧化物,但SO2具有较强的还原性,CO2无还原性,反应原理应该不相同,并设计如下实验进行探究.
某校化学兴趣小组在学习了过氧化钠性质后,进一步研究其与SO2反应情况,查阅相关资料知:过氧化钠与CO2反应有气体生成,而将SO2通入过氧化钠粉末中也有气体生成.有同学认为:CO2、SO2虽然都是酸性氧化物,但SO2具有较强的还原性,CO2无还原性,反应原理应该不相同,并设计如下实验进行探究.| 实验步骤(不要求写出具体操作过程) | 预期的实验现象和结论 |
| 取反应后的固体放入试管中,… |
| SO2被氧化的程度 | V与m1或m2的关系 |
| 完全被氧化 | V=0 |
| 部分被氧化 | |
| 未被氧化 |
| 实验步骤(不要求写出具体操作过程) | 预期的实验现象和结论 |
| 取反应后的固体放入试管中,加少量水溶解,加入BaCl2溶液,再加入稀盐酸. | 加入BaCl2溶液有白色沉淀产生,加入盐酸沉淀部分溶解. 证明原固体中既有亚硫酸钠也有硫酸钠. |
| 7m1 |
| 30 |
| 30V |
| 7 |
| 7m1 |
| 30 |
| SO2被氧化的程度 | V与m1或m2的关系 |
| 完全被氧化 | V=0 |
| 部分被氧化 | 0<V<7m1/30 或m1>30V/7 |
| 未被氧化 | V=7m1/30或m1=30V/7 |


 名题金卷系列答案
名题金卷系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
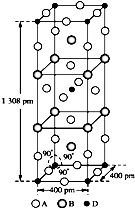 前四周期原子序数依次增大的元素A、B、C、D中,A和B的价电子层中未成对电子均只有1个,并且A-和B+的电子数相差为8;与B位于同一周期的C和D,它们价电子层中的未成对电子数分别为4和2,且原子序数相差为2.回答下列问题:
前四周期原子序数依次增大的元素A、B、C、D中,A和B的价电子层中未成对电子均只有1个,并且A-和B+的电子数相差为8;与B位于同一周期的C和D,它们价电子层中的未成对电子数分别为4和2,且原子序数相差为2.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| t/s | 0 | 5 | 10 | 20 | 30 |
| n(A)/moL | 1 | 0.8 | 0.75 | 0.70 | 0.70 |
| A、反应在前 5s 的平均速率v (A)=0.04mol?L-1 |
| B、相同温度下,若平衡后再向容器中充入 0.5 mol A 和 0.5 mol C,反应再次达到平衡前v (正)>v (逆) |
| C、相同温度下,若平衡后移走 0.5 mol A 和 0.5 mol B,反应再次达到平衡时 c(C)小于 0.075 mol?L-1 |
| D、相同温度下,若起始时向容器中充入 2.0 mol C,达到平衡时,C 的转化率大于 70% |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、10% | B、大于10% |
| C、小于10% | D、5% |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com